题目内容
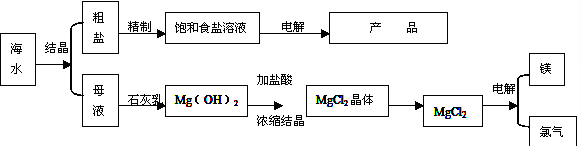
(16分)下图是某化工厂对海水资源的综合利用的示意图。
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是: (填物理变化、化学变化)
(2)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的离子方程式为: 。阳极产生气体的如何检验 。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐: t。
(3)分离出粗盐的母液中含有Mg2+,从图中可看出对母液进行一系列的加工可制得金属镁。
①在母液中加入石灰乳所起的作用是: 。
②从充分利用当地海洋化学资源,就地取材,经济效益的角度考虑,生产生石灰的原料可是: 。
③电解熔融氯化镁的化学方程式是: 。
④氮气和氩是两种化学性质相对稳定的气体,都可用做白炽灯的填充气体。但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩。试用化学反应方程式解释不选用氮气的原因: 。

(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是: (填物理变化、化学变化)
(2)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的离子方程式为: 。阳极产生气体的如何检验 。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐: t。
(3)分离出粗盐的母液中含有Mg2+,从图中可看出对母液进行一系列的加工可制得金属镁。
①在母液中加入石灰乳所起的作用是: 。
②从充分利用当地海洋化学资源,就地取材,经济效益的角度考虑,生产生石灰的原料可是: 。
③电解熔融氯化镁的化学方程式是: 。
④氮气和氩是两种化学性质相对稳定的气体,都可用做白炽灯的填充气体。但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩。试用化学反应方程式解释不选用氮气的原因: 。
(1)物理变化 (2)2Cl- +2H2O 2OH-+H2 ↑+Cl2 ↑ 湿润的淀粉碘化钾试纸 58.5
2OH-+H2 ↑+Cl2 ↑ 湿润的淀粉碘化钾试纸 58.5
(3)①将镁离子转化为沉淀而分离 ②贝壳 ③MgCl2 Mg +Cl2 ↑
Mg +Cl2 ↑
④3Mg +N2 Mg3N2
Mg3N2
 2OH-+H2 ↑+Cl2 ↑ 湿润的淀粉碘化钾试纸 58.5
2OH-+H2 ↑+Cl2 ↑ 湿润的淀粉碘化钾试纸 58.5(3)①将镁离子转化为沉淀而分离 ②贝壳 ③MgCl2
 Mg +Cl2 ↑
Mg +Cl2 ↑④3Mg +N2
 Mg3N2
Mg3N2 试题分析:(1)蒸馏法是利用物质的沸点不同进行分离两种互溶的液体的方法,所以蒸馏法是物理变化。
(2)电解饱和食盐水的离子方程式:2Cl- +2H2O
 2OH-+H2 ↑+Cl2 ↑。阳极产生的是Cl2,检验Cl2的方法是用湿润的淀粉碘化钾试纸,当试纸变蓝说明有Cl2生成。利用电解所得气体制的36.5%的浓盐酸100t,则需要HCl 36.5t,因此需要NaCl 58.5t。
2OH-+H2 ↑+Cl2 ↑。阳极产生的是Cl2,检验Cl2的方法是用湿润的淀粉碘化钾试纸,当试纸变蓝说明有Cl2生成。利用电解所得气体制的36.5%的浓盐酸100t,则需要HCl 36.5t,因此需要NaCl 58.5t。(3)①Mg2+可以和OH-反应生成Mg(OH)2,所以在母液中加入石灰乳是将镁离子转化为沉淀而分离。②海边的贝壳主要是CaCO3,CaCO3受热分解得到CaO。③电解熔融氯化镁的化学方程式是:MgCl2
 Mg +Cl2 ↑。④氮气可以和镁反应:3Mg +N2
Mg +Cl2 ↑。④氮气可以和镁反应:3Mg +N2 Mg3N2。
Mg3N2。点评:本题综合性较强,考查的知识点比较基础简单。

练习册系列答案
相关题目

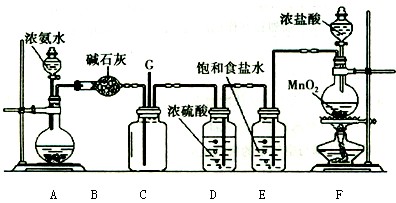
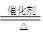 4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
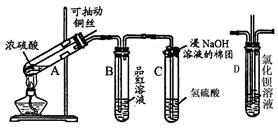
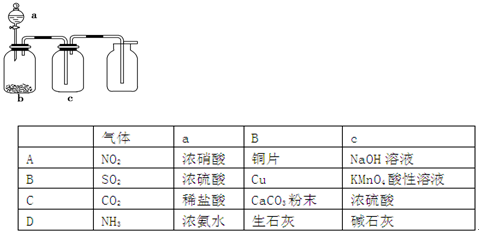

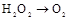
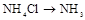
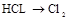
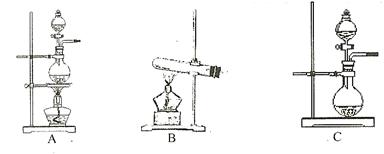
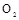 的装置制备
的装置制备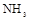 ,应选择的试剂为 .
,应选择的试剂为 .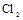 需用
需用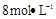 的盐酸1OOml,现用
的盐酸1OOml,现用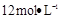 的盐酸来配制。
的盐酸来配制。