��Ŀ����
����Ŀ��ijУ��ѧ��ȤС������ͼװ�ý���SO2��FeCl3��Һ�ķ�Ӧ 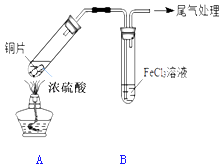
��1��д��װ��A�в���SO2�Ļ�ѧ����ʽ�� ��
��2����С��ͬѧ��ΪSO2��FeCl3��Һ�ܷ�����Ӧ�������� �� ��Ӧǰ��B����Һ����ɫ�仯Ϊ�� ��
��3�������������ʣ���Ԥ��FeCl3�����ܾ��е������ǣ��������ӷ���ʽ��ʾ����дһ�����ɣ� �� �����ʵ��֤�����Ԥ�⣨��ѡ���Լ���ʵ������������۽��б����� ��
���𰸡�
��1��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
��2��B���Ȼ�����Һ��ɫ�仯����dz��ɫ��Ϊdz��ɫ
��3��Fe3++3OH��=Fe��OH��3����ȡ������Һ�μ�����������Һ,�۲����ɺ��ɫ����
���������⣺��1��װ��A����ͭ��Ũ������ȷ�Ӧ��������ͭ�����������ˮ���Ʊ�����������ʽΪ��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��
���Դ��ǣ�Cu+2H2SO4��Ũ�� ![]() . CuSO4+SO2��+2H2O����2��B����Һ�ɻ�ɫ��Ϊdz��ɫ��˵������������Ȼ�������������ԭ��Ӧ�����Դ��ǣ�B���Ȼ�����Һ��ɫ�仯����dz��ɫ��Ϊdz��ɫ����3���Ȼ������������ԣ�����֮�����Ӧ���ɺ��ɫ������������������Fe3++3OH��=Fe��OH��3������ȡ������Һ�μ�����������Һ���۲����ɺ��ɫ������
. CuSO4+SO2��+2H2O����2��B����Һ�ɻ�ɫ��Ϊdz��ɫ��˵������������Ȼ�������������ԭ��Ӧ�����Դ��ǣ�B���Ȼ�����Һ��ɫ�仯����dz��ɫ��Ϊdz��ɫ����3���Ȼ������������ԣ�����֮�����Ӧ���ɺ��ɫ������������������Fe3++3OH��=Fe��OH��3������ȡ������Һ�μ�����������Һ���۲����ɺ��ɫ������
���Դ��ǣ�Fe3++3OH��=Fe��OH��3����ȡ������Һ�μ�����������Һ���۲����ɺ��ɫ������

 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д� ����������ϵ�д�
����������ϵ�д�����Ŀ�������Ԫ�����ڱ���һ���֣��ش���������
���� | IA | ��A | ��A | ��A | ��A | ��A | ��A |
1 | |||||||
2 | �� | �� | �� | ||||
3 | �� | �� | �� | ||||
��1������Ԫ�آ�����⻯��ĵ���ʽΪ �� Ԫ�آۺ͢ݶ�Ӧ���⻯����ȶ�������д��ѧʽ����ͬ����Ԫ�آں͢�Ӧ����������ˮ�������Խ�ǿ���� ��
��2����ҵ�������ʢܵ�ԭ�������û�ѧ����ʽ��ʾ����
��3����֪ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ���Ԫ�آ���Ԫ�آܵ��������������Ƶ����ʣ�д��Ԫ�آٵ�����������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
��4��0.2mol�ĵ��ʢ���100mL2molL��1��FeBr2��Һ��Ӧ����������Fe2+��Br�������ʵ���֮���� ��