题目内容
18.(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol.(2)已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol
则2N2(g)+6H2O(g)═4NH3(g)+3O2(g)△H=+1530.0kJ•mol-1.
分析 (1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,根据盖斯定律写出其热化学反应方程式;
(2)根据盖斯定律将①×2-②×3可得:2N2(g)+6H2O(g)═4NH3(g)+3O2(g),据此计算出该反应的焓变.
解答 解:(1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol.
故答案为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol;
(2)①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
②2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol
根据盖斯定律①×2-②×3可得:2N2(g)+6H2O(g)═4NH3(g)+3O2(g)△H=(-92.4kJ/mol)×2-(-571.6kJ/mol)×3=+1530.0 kJ•mol-1,
故答案为:+1530.0 kJ•mol-1.
点评 本题考查了盖斯定律在热化学方程式中的应用、热化学方程式的书写,题目难度中等,注意掌握热化学方程式的书写原则,明确盖斯定律的含义及在反应热计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
16.体积为VmL,密度为dg•cm-3的溶液,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol•L-1,质量分数为w,下列表达式正确的是( )
| A. | c=$\frac{w×1000×d}{M}$ | B. | m=V×d×$\frac{w}{100}$ | C. | w=$\frac{c×M}{1000×d}$% | D. | c=$\frac{1000×m}{V×M}$ |
17.下列实验符合安全要求且能达到实验目的是( )
| A. | 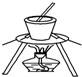 从食盐水中提取NaCl | B. | 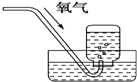 收集氧气 | ||
| C. | 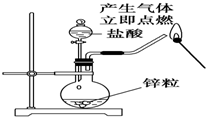 制备并检验氢气的可燃性 | D. | 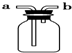 从a口进气可收集H2 |
6.下列有关说法正确的是( )
| A. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol•L-1 | |
| C. | Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| D. | 1molNa2O2固体中含离子总数为3NA |
3.发射飞船的火箭使用的燃料是液氢和液氧.如果1g液氧中含有n个氧原子,则阿伏加德罗常数的值可表示为( )
| A. | $\frac{16}{n}$ | B. | n | C. | 16n | D. | 32n |
10.在下列指定溶液中,离子一定能大量共存的是( )
| A. | 加入H+有气体产生的溶液中:SO${\;}_{3}^{2-}$、Ba2+、K+、NO${\;}_{3}^{-}$ | |
| B. | 使酚酞显红色的溶液中:NO${\;}_{3}^{-}$、Cl-、K+、Ba2+ | |
| C. | 加铁粉能放出氢气的溶液中:Na+、H+、CH3COO-、Cl- | |
| D. | 呈酸性的无色溶液中:K+、Fe2+、NO32-、SO42- |