题目内容
16.下列有关化学用语表示正确的是( )| A. | 过氧化钠的电子式: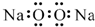 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 硫原子的结构示意图: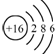 | D. | NH4Cl的电子式: |
分析 A.过氧化钠是离子化合物,其电子式符合离子化合物特点;
B.次氯酸中Cl为+1价,与O形成一对共价键,据此解答即可;
C.硫原子核外有16个电子、分为三层,最外层有6个电子;
D.氯化铵中氯离子为简单阴离子,需要中括号,据此解答即可.
解答 解:A.过氧化钠是离子化合物,电子式中需要标出电荷,其正确电子式为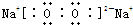 ,故A错误;
,故A错误;
B.次氯酸的结构式为H-O-Cl,故B错误;
C.硫原子核外有16个电子、最外层有6个电子,其原子结构示意图为 ,故C正确;
,故C正确;
D.氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: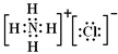 ,故D错误,
,故D错误,
故选C.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
相关题目
6.四个体积相同的密闭容器中,在一定条件下,发生如下反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,化学反应速率最小的是( )
| 容器 | 温度(℃) | N2(mol) | H2(mol) | 催化剂 |
| A | 500 | 1 | 3 | 有 |
| B | 500 | 0.5 | 1.5 | 有 |
| C | 450 | 1 | 3 | 无 |
| D | 450 | 0.5 | 1.5 | 无 |
| A. | A | B. | B | C. | C | D. | D |
7.已知反应3Cl2+8NH3═N2+6NH4Cl下列说法正确的是( )
| A. | NH3被氧化,表现氧化性 | |
| B. | 此条件下氧化性强弱为:Cl2>N2 | |
| C. | 若有8mol NH3 被氧化,生成的N2体积(标准状况)为22.4L | |
| D. | 若有3 mol e-转移,被还原的Cl2的物质的量为3mol |
11.下列离子方程式中不正确的是( )
| A. | 铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 二氧化碳通入澄清石灰水中CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | 氢氧化钡溶液与盐酸混合OH-+H+═H2O |
8.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol.下列说法正确的是( )
反应前CO物质的量为10mol,平衡后CO物质的量为8mol.下列说法正确的是( )
| A. | 降低温度,H2S浓度减小,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为10 mol | |
| D. | H2S的平衡转化率为28.6% |
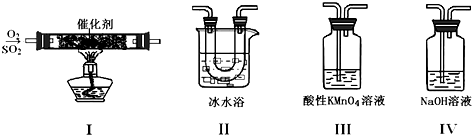
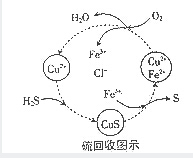 H2S、金属硫化物是硫的重要化合物.
H2S、金属硫化物是硫的重要化合物.