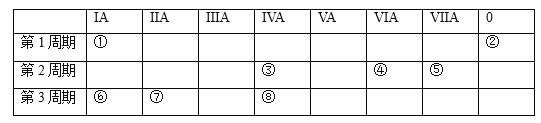
��Ŀ����
����Ŀ��(��)50mL0.5mol��L-1��������50mL0.55mol��L-1��NaOH��Һ����ͼ��ʾ��λ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����зų��������ɼ����к��ȡ��ش��������⣺
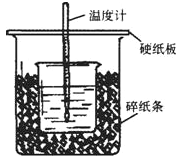
(1)��ʵ��װ���Ͽ�����֪��ͼװ������������֮������ָ��____________��
(2)�ڲⶨ�к��ȵ�ʵ���У����㷴Ӧ��ʱ��Ҫ��������_________
�����Ũ�Ⱥ���� �ڼ��Ũ�Ⱥ���� �۱����� �ܷ�Ӧǰ����Һ���¶Ȳ� �ݲ�������ʱ��
A.�٢ڢۢ� B. �٢ڢۢ� C. �ڢۢܢ� D. �٢ۢܢ�
(3)ʵ���и���60mL0.50mol��L-1�������50mL0.55mol��L-1��NaOH��Һ���з�Ӧ��������ʵ����ȣ������к���_________(���ȡ�����ȡ�)�����ų�������________(���ȡ�����ȡ�)��
(4)����ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к�����ֵ��______���ƫ����ƫС������Ӱ�족����
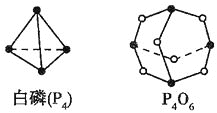
(��)��5����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̣���ѧ���ļ������γ�(���)1mol��ѧ��ʱ�ͷ�(������)����������֪����P4O6�ķ��ӽṹ����ͼ��ʾ�����ṩ���»�ѧ���ļ��ܣ�![]() ��
��![]() kJ��mol-1��
kJ��mol-1��![]() ��
��![]() kJ��mol-1��
kJ��mol-1��![]() ��
��![]() kJ��mol-1����ӦP4(����)+3O2=P4O6���Ȼ�ѧ��Ӧ����ʽΪ__________________��
kJ��mol-1����ӦP4(����)+3O2=P4O6���Ȼ�ѧ��Ӧ����ʽΪ__________________��
(6)��(N2H4)����Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������
��֪����N2(g)+2O2(g)�TN2O4(l) ��H1�T-19.5kJmol-1
��N2H4(l)+O2(g)�TN2(g)+2H2O(g) ��H2�T-534.2kJmol-1
д���º�N2O4��Ӧ���Ȼ�ѧ����ʽ___________________ ��
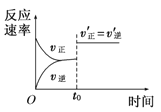
(7)��ѧ��ӦN2+3H2![]() 2NH3�������仯��ͼ��ʾ���÷�Ӧ����NH3(I)���Ȼ�ѧ����ʽ��______________��
2NH3�������仯��ͼ��ʾ���÷�Ӧ����NH3(I)���Ȼ�ѧ����ʽ��______________��
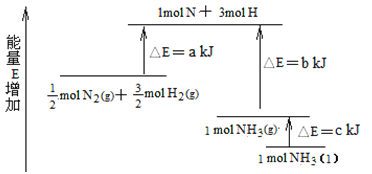
���𰸡����β�����������ڴ�С�ձ���û����������ĭ(��ֽ��)��С�ձ�������ձ��ڲ����B�������ƫСP4(���� s)+N2O4(I)=3N2(g)+2H2O(g)�� ��H=��1638kJ��mol-12N2H4(I)+N2O4(I)=3N2(g)+4H2O(g) ��H=-1048.9kJ/molN2(g)+3H2(g)![]() 2NH3(I) ��H=2(a-b-c)kJ��mol-1
2NH3(I) ��H=2(a-b-c)kJ��mol-1
��������
��1��Ϊ�˲���¶ȵ����ֵ��Ӧ����̵�ʱ������������������Ƴ�ַ�Ӧ����ȱ�ٻ��β����������Ϊ�˲���¶ȵ����ֵ��Ӧ��ǿ���¡����Ⱥͷ�ֹ����ɢʧ��ʩ��Ӧ���ڴ�С�ձ�����������ĭ����ֽ��������ʹС�ձ�������ձ�����ƽ��
(2)�ڲⶨ�к��ȵ�ʵ���У����㷴Ӧ��ʱ��Ҫ�����������Ũ�Ⱥ���������Ũ�Ⱥ�����������ݡ���Ӧǰ����Һ���¶Ȳ��ʵ���������ʱ���أ���ѡ��B�������⣻
(3)��Ӧ�ų����������������Լ�������Ķ����йأ�������60mL0.50molL-1������50mL0.55molL-1NaOH��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����1molˮʱ�ų����ȣ������������أ��к�����ֵ��ȣ�
(4)��ˮΪ����������Ϊ���ȹ��̣������ð�ˮ����ϡ����������Һ��Ӧ����Ӧ�ų�������С��57.3kJ��
(5)����ȼ�շų�������=������ļ���-��Ӧ��ļ���=12��360 kJ-��6��198��kJ-��3��498��kJ=1638 kJ����Ӧ���ʱ���-1638 KJ/mol����ӦP4�����ף�ȼ������P4O6���Ȼ�ѧ����ʽΪ��P4��s��+3O2��g��=P4O6��g����H=-1638 KJ/mol��
��6��N2��g��+2O2��g��=N2O4��l����H1=-19.5kJmol-1
��N2H4��l��+O2 ��g��=N2��g��+2H2O��g����H2=-534.2kJmol-1
���ݸ�˹����д���º�N2O4��Ӧ���Ȼ�ѧ���̣��ڡ�2-�ٵõ���2N2H4��l��++N2O4��l��=3N2��g��+4H2O��g����H=-1048.9 kJ/mol��
��7����ͼ��֪������1mol NH3��g���ų�������Ϊb-akJ���������ΪҺ�壬�ų�����ΪckJ����N2��g��+3H2��g��=2NH3��1����H=-2��b-a��kJ/mol+2��-c��kJ/mol=2��a-b-c��kJmol-1��

����Ŀ��(1)��ʯ��ʯΪԭ��ͨ��ϵ�з�Ӧ����Ԫ����CaSO4����ʽ�̶����Ӷ�����SO2���ŷš���ط�Ӧ���Ȼ�ѧ����ʽ���£�CaSO4 (s)+CO (g) ![]() CaO(s)+SO2 (g)+CO2 (g) ��H1= +218.4kJ��mol��1(��Ӧ��)��CaSO4 (s) +4CO (g)
CaO(s)+SO2 (g)+CO2 (g) ��H1= +218.4kJ��mol��1(��Ӧ��)��CaSO4 (s) +4CO (g) ![]() CaS(s) +4CO2(g)��H2=��175.6kJ��mol��1 (��Ӧ��)����Ϸ�Ӧ��д��CaSO4 (s)��CaS (s) ��Ӧ���Ȼ�ѧ��Ӧ����ʽ_______��
CaS(s) +4CO2(g)��H2=��175.6kJ��mol��1 (��Ӧ��)����Ϸ�Ӧ��д��CaSO4 (s)��CaS (s) ��Ӧ���Ȼ�ѧ��Ӧ����ʽ_______��
(2)NO2��SO2�����ϴ������������ת��ƽ�⣺NO2(g)+SO2(g)![]() SO3(g)+NO(g)��ij�С��Դ˷�Ӧ�����о�ʵ��
SO3(g)+NO(g)��ij�С��Դ˷�Ӧ�����о�ʵ��
ʵ������ | ʵ������ | ���� | |
�� | ������NO2��SO2������ܱ���ƿ������ˮ�� | �������ɫ���һ��ʱ�����ɫ���ٱ仯 | ��H___0 (�������) |
�� | ����Ͳ�г���5mL NO2��5mL SO2���壬�����Ͳǰ�ˣ���ַ�Ӧ������Ѹ������5mL�� | �������ɫ������ֲ��� | ƽ��____(���������һ�)�ƶ� |
�� | �ڳ���NO2��SO2�������ĺ��������У���ƽ������ͨ��SO2���� | _____ | ƽ�������ƶ���SO2��ת����____(������С��) |
(3)��ҵ���û���̿��ԭ������NO���йط�ӦΪ��C(s) +2NO(g)![]() N2(g) +CO2(g)��Ϊ�����NO��ת���ʣ����еĴ�ʩ���е���___��
N2(g) +CO2(g)��Ϊ�����NO��ת���ʣ����еĴ�ʩ���е���___��
A���ټ���һ������̼ B������ѹǿ C���ü�Һ�������� D��ʹ�ô���