题目内容
在体积均为1L,pH均等于2的盐酸和醋酸中,分别投入0.28g Fe,则下图中的曲线符合反应事实的是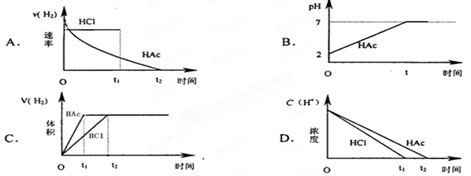

C
试题分析:在体积均为1L,pH均等于2的盐酸和醋酸中相对铁来说,都是过量的,但是醋酸是弱酸,一边反应,一边电离出氢离子,所以反应速率盐酸的小于醋酸的。故选C。
点评:对于解答此类的问题,学生一定要找到其问题的实质,即在此题中的实质是:浓度对化学反应速率的影响。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
题目内容


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案