��Ŀ����
����Ŀ�����λ�����Ǧ(3PbO��PbSO4��H2O������Է�������Ϊ990)��ơ����Ρ���������ˮ���л��ܼ�����Ҫ�����ڲ����ľ�����ϩӲ�ʹܡ�ע�������Ʒ��Ҳ������������������Ʒ����Ǧ�� (��Ҫ�ɷ�ΪPbO��Pb��PbSO4��)Ϊԭ���Ʊ����εĹ�����������ͼ��ʾ��
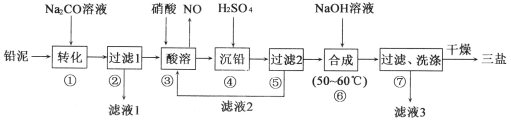
��֪��KSP(PbSO4)=1.82��10-8��KSP(PbCO3)=1.46��10-13��ش��������⣺
(1)д������١�ת���������ӷ���ʽ__________________��
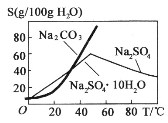
(2)������ͼ�ܽ������(g/100gˮ)������ҺI�õ�Na2SO4����IJ���Ϊ��������Һ1����_________��_________�����Ҵ�ϴ�Ӻ���
(3)����ۡ����ܡ���Ϊ����������ʣ��ɲ�ȡ�Ĵ�ʩ��________________(����д��һ��)
(4)����Һ2���п�ѭ�����õ�����Ϊ_______(�ѧʽ)��������ܡ���Ǧ�������Һ��c(Pb2+)=1.82��10-5 mol��L-1�����ʱc(SO42-)=________mol��L-1��
(5)����ޡ��ϳɡ����εĻ�ѧ����ʽΪ____________________��
(6)������100.0tǦ�࣬���յõ��������������49.5t������Ǧ���е�ǦԪ����75��ת��Ϊ���Σ���Ǧ����ǦԪ�ص���������Ϊ___________��
���𰸡�PbSO4+CO32-=PbCO3+SO42- ���½ᾧ ���ȹ��� �ʵ����£��ʵ���������Ũ�ȣ��������۴����������ȣ� HNO3 1��10-3 4PbSO4+6NaOH![]() 3PbOPbSO4H2O +3Na2SO4+2H2O 55.20%
3PbOPbSO4H2O +3Na2SO4+2H2O 55.20%
��������
��1������KSP(PbSO4)=1.82��10-8��KSP(PbCO3)=1.46��10-13�����Բ���ټ���̼������Һ��������Ǧת��Ϊ̼��Ǧ��
��2��������Һ1�����½ᾧ�����ȹ��ˡ����Ҵ�ϴ�Ӻ����õ�Na2SO4���壻
��3��Ϊ����������ʣ����ʵ����£����ʵ���������Ũ�ȣ��������۴����������ȣ�
��4��Pb��PbO��PbCO3�������������ת����Pb��NO3��2��Pb��NO3��2�м�ϡH2SO4ת����PbSO4�����ᣬHNO3��ѭ�����ã�����KSP(PbSO4)=1.82��10-8������Һ��c��Pb2+��=1.82��10-5mol/L������Һ�е�c(SO42-)= KSP(PbSO4)/c��Pb2+��=1.82��10-8/1.82��10-5=1��10-3mol/L��
��5�����ϳɡ����εĻ�ѧ����ʽΪ4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O��
3PbOPbSO4H2O+3Na2SO4+2H2O��
��6������ǦԪ���غ����Ǧ����ǦԪ�ص�����������
��1������KSP(PbSO4)=1.82��10-8��KSP(PbCO3)=1.46��10-13�����Բ���ټ���̼������Һ��������Ǧת��Ϊ̼��Ǧ�������ԭ�ϵ������ʣ���Ӧ�Ļ�ѧ����ʽΪPbSO4+Na2CO3=PbCO3+Na2SO4�����ӷ���ʽΪ��PbSO4+CO32-=PbCO3+SO42-��
�ʴ�Ϊ��PbSO4+CO32-=PbCO3+SO42-��
��2����Һ���������Ҫ��Na2SO4������Na2CO3��������Һ1�����½ᾧ�����ȹ��ˡ����Ҵ�ϴ�Ӻ����õ�Na2SO4���壬
�ʴ�Ϊ�����½ᾧ�����ȹ��ˡ�
��3��Ϊ����������ʣ����ʵ����£����ʵ���������Ũ�ȣ��������۴����������ȣ�
�ʴ�Ϊ���ʵ����£��ʵ���������Ũ�ȣ��������۴����������ȣ���
��4��Pb��PbO��PbCO3�������������ת����Pb��NO3��2��Pb��NO3��2�м�ϡH2SO4ת����PbSO4�����ᣬHNO3��ѭ�����ã�����KSP(PbSO4)=1.82��10-8������Һ��c��Pb2+��=1.82��10-5mol/L������Һ�е�c(SO42-)= KSP(PbSO4)/c��Pb2+��=1.82��10-8/1.82��10-5=1��10-3mol/L��
�ʴ�Ϊ��HNO3��1��10-3��
��5��������Ŀ���������ת����ϵ������ޡ��ϳɡ����εĻ�ѧ����ʽΪ4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O��
3PbOPbSO4H2O+3Na2SO4+2H2O��
�ʴ�Ϊ��4PbSO4+6NaOH![]() 3PbOPbSO4H2O +3Na2SO4+2H2O��
3PbOPbSO4H2O +3Na2SO4+2H2O��
��6����Ǧ����ǦԪ�ص���������Ϊx������ǦԪ���غ�ɵã�
100.0��106g��x��75%/207g/mol=49.5��106g/990g/mol��4�����x=0.5520������Ǧ����ǦԪ�ص���������Ϊ55.20%���ʴ�Ϊ��55.20%��

 ��������������������ϵ�д�
��������������������ϵ�д�