题目内容
【题目】下列实验所选择的试剂、装置或仪器(夹持装置已略 去)能达到相应实验目的的是
A. 提取溴水中的溴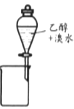
B. 验证石蜡油分解产物中含有烯烃
C. 验证H2O2 分解时二氧化锰的催化效果优于氯化铁
D. 量取20.00mL 0.1000mol/L HCl溶液
【答案】B
【解析】
A、酒精与水混溶、不分层,酒精不能从溴水萃取溴,故A错误;
B、石蜡油分解产物能使酸性高锰酸钾溶液褪色,证明其分解产物中含有烯烃,故B正确;
C、验证H2O2 分解时二氧化锰的催化效果优于氯化铁时,要控制其它条件相同,取双氧水的浓度要相同,故C错误;
D、量筒的精确度为0.1mL,量取20.00mL 0.1000mol/L HCl溶液,要用酸式滴定管或移液管,故D错误。
故选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目





