题目内容
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热量,已知:0.8 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出513.3 kJ的热量。
(1)反应的热化学方程式为 ;
(2)又已知:H2O(g)===H2O(l);△H= —44 kJ/mol,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 ;
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(6分) (1) N2H4(l)+2H2O2(l)==N2(g)+4H2O(g) △H=-641.63kJ/mol ;
(2) 408.815 kJ ;(3) 对环境无污染 。(各2分)
【解析】
试题分析:(1)0.8 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出513.3 kJ的热量,则1mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气是发出的热量是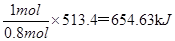 ,所以该反应的热化学方程式是N2H4(l)+2H2O2(l)==N2(g)+4H2O(g) △H=-641.63kJ/mol。
,所以该反应的热化学方程式是N2H4(l)+2H2O2(l)==N2(g)+4H2O(g) △H=-641.63kJ/mol。
(2)由于H2O(g)===H2O(l);△H= —44 kJ/mol,则1mol液态肼与足量的液态双氧水反应,生成氮气和液态水是发出的热量是641.63kJ+44 kJ×4=817.63kJ,16g液态肼的物质的量是16g÷32g/mol=0.5mol。所以16 g液态肼与液态双氧水反应生成液态水时放出的热量是817.63kJ×0.5=408.815 kJ。
(3)根据方程式可知,生成物是水和氮气,对环境无污染。
考点:考查热化学方程式的书写以及反应热的计算
点评:该题是高考中的常见题型,属于中等难度的考查,试题难易适中,侧重对学生基础知识对巩固与训练,有助于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
