题目内容
4.图象法是研究化学反应的焓变的一种常用方法.
(1)已知化学反应A2(g)+B2(g)═=2AB(g)的能量变化曲线如图1所示,判断下列叙述中正确的是B.
A.每生成2mol AB时吸收 b kJ 热量
B.该反应热△H=+(a-b) kJ•mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol A-A和1mol B-B键时放出a kJ能量
(2)在微生物作用的条件下,NH${\;}_{4}^{+}$经过两步反应被氧化成NO${\;}_{3}^{-}$.两步反应的能量变化如2图所示:1mol NH${\;}_{4}^{+}$(aq)全部氧化成NO${\;}_{3}^{-}$(aq)的热化学方程式是NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1.
(3)图3中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素.
①非金属元素氢化物的稳定性与氢化物生成热△H的关系为非金属元素氢化物越稳定,△H越小,反之亦然.
②写出硒化氢发生分解反应的热化学方程式H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
分析 (1)A、依据图象分析判断1molA2和1molB2反应生成2molAB;
B、反应热△H=反应物能量总和-生成物能量总和;
C、依据能量图象分析可知反应物能量低于生成物能量;
D、断裂化学键吸收能量;
(2)由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273 kJ•mol-1,第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ•mol-1,利用盖斯定律可计算1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式;
(3)①根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,以此进行判断;
②根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.
解答 解:(1)A.依据图象分析判断1molA2和1molB2反应生成2molAB,每生成2molAB吸收(a-b) kJ热量,故A错误;
B.由图象可知该反应热△H=+(a-b)kJ•mol-1,故B正确;
C.由图象可知,反应物总能量小于生成物总能量,故C错误;
D.断裂化学键吸收能量,故D错误.
故选B;
(2)由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273 kJ•mol-1①,
第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ•mol-1②,
由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式为NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1,
故答案为:NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1;
(3)①非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O,
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
②由①可知,b为硒化氢的生成热数据,则硒化氢分解吸热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,
故答案为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
点评 本题考查了化学反应的能量变化,图象分析判断以及盖斯定律的应用,为高频考点,注意反应热△H=反应物能量总和-生成物能量总和,题目难度中等.

| A | B | C | D | |
| X | 物质中的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
| Y | 阿伏加德罗常数 | 标准状况下的气体的体积 | 固体的密度 | 溶液体积 |
| A. | A | B. | B | C. | C | D. | D |
| A. | S和热NaOH溶液的反应:4S+8NaOH═3Na2S+Na2SO4+4H2O | |
| B. | 除去CO2中的CO:2CO+O2═2CO2 | |
| C. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 向漂白粉溶液中通入少量SO2气体:SO2+H2O+Ca2++ClO-═CaSO4+2H++Cl- |
| A. | 某物质在固态时能导电,可确认该物质是金属单质 | |
| B. | 一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态 | |
| C. | 氧化物只可能是氧化产物,不可能是还原产物 | |
| D. | 有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应 |
| A. | ${\;}_{55}^{\;}$Br的电子排布式可简写为[Ar]4s24p5 | |
| B. | 16O与18O互为同位素,H216O、H218O互为同素异形体 | |
| C. | CH4、NH${\;}_{4}^{+}$粒子的空间构型均为正四面体形 | |
| D. | NH4Cl的电子式为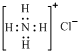 |