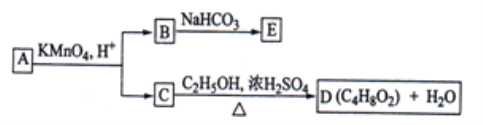
题目内容
【题目】几种主族元素在周期表中的位置如下
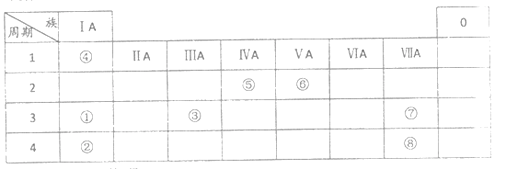
根据上表回答下列问题:
(1)⑥元素的氢化物是_________ (填化学式)
(2)①③⑦三种元素原子半径由大到小的顺序是_________(填元素符号)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_________,该元素在周期表中的位置是__________________。
(4)①②③三种元素氧化物对应水化物碱性最强的是_________(填化学式),①与水反应的化学方程式为_________。
(5)⑦非金属性强于⑧,从原子结构的角度解释其原因:_________。下列表述中能证明这一事实的是_________ (填序号)
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物的水化物的酸性强于⑧最高价氧化物的水化物的酸性
c.⑦能将⑧从其钠盐溶液中置换出来
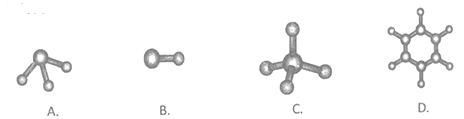
(6)④与⑤元素形成的分子可能是_________ (填字母序号)
【答案】NH3 Na>Al>Cl 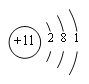 3周期IA族 KOH 2Na + 2H2O=2NaOH+H2↑ Cl、 Br处于同一主族(VIIA族),易得1个电子,Cl的原子半径比Br小,核对最外层电子的吸引能力强,Cl的得电子能力强,非金属性强。 a、 b、 c C、D
3周期IA族 KOH 2Na + 2H2O=2NaOH+H2↑ Cl、 Br处于同一主族(VIIA族),易得1个电子,Cl的原子半径比Br小,核对最外层电子的吸引能力强,Cl的得电子能力强,非金属性强。 a、 b、 c C、D
【解析】
根据元素在周期表中的相对位置可知各元素是:①Na、②K、③Al、④H、⑤C、⑥N、⑦Cl、⑧Br。
(1)⑥是N元素,最低负价-3价;
(2)①③⑦三种元素处于第3周期,从左到右原子半径逐渐减小;
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素为Na。
(4)①②③三种元素的金属性K>Na>Al;钠与水反应生成氢氧化钠和氢气。
(5)根据非金属性强弱比较规律分析解答;
(6)④为H元素与⑤为C元素形成的分子可能是烃,碳有4个价电子,满足条件的C和D,分别是甲烷和苯。
(1)⑥是N元素,最低负价-3价,氢化物是NH3;
(2)①③⑦三种元素处于第3周期,从左到右原子半径逐渐减小,原子半径由大到小的顺序是Na>Al>Cl(填元素符号)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为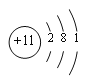 ,该元素在周期表中的位置是3周期IA族。
,该元素在周期表中的位置是3周期IA族。
(4)①②③三种元素的金属性K>Na>Al,①②③三种元素氧化物对应水化物碱性KOH>NaOH>Al(OH)3,最强的是KOH,钠与水反应生成氢氧化钠和氢气,①与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑。
(5)⑦非金属性强于⑧,从原子结构的角度解释其原因为Cl、Br处于同一主族(VIIA族),易得1个电子,Cl的原子半径比Br小,核对最外层电子的吸引能力强,Cl的得电子能力强,非金属性强。
a.⑦的氢化物比⑧的氢化物稳定,证明非金属性Cl>Br,故正确;
b.⑦最高价氧化物的水化物的酸性强于⑧最高价氧化物的水化物的酸性,证明非金属性Cl>Br,故正确;
c.⑦能将⑧从其钠盐溶液中置换出来,氯能将溴离子氧化,证明非金属性Cl>Br,故正确;
故选a、b、c。
(6)④为H元素与⑤为C元素形成的分子可能是烃,碳有4个价电子,满足条件的C和D,分别是甲烷和苯。答案选CD。