题目内容
(5分)在密闭容器中,通入xmolH2和ymolI2(g),改变下列条件,反应速率将如何改变?(填“增大”、“减小”或“不变”)
(1)升高温度 ;
(2)加入催化剂 ;
(3)容器容积充入H2 ;
(4)扩大容器的体积
(5)容器容积不变,通入氖气
(1)升高温度 ;
(2)加入催化剂 ;
(3)容器容积充入H2 ;
(4)扩大容器的体积
(5)容器容积不变,通入氖气
(1)增大(2)增大或减小(3)增大(4)减小(5)不变(各1分)
考查外界条件对反应速率的影响。
(1)升高温度,反应速率移动加快。
(2)催化剂可以改变反应速率,因此可能增大也可能减小。
(3)充入氢气,则增大反应物浓度,反应速率加快。
(4)扩大容器容积,则压强降低,反应速率减小。
(5)容器容积不变,充入氖气,由于反应物的浓度不变,所以反应速率是不变的。
(1)升高温度,反应速率移动加快。
(2)催化剂可以改变反应速率,因此可能增大也可能减小。
(3)充入氢气,则增大反应物浓度,反应速率加快。
(4)扩大容器容积,则压强降低,反应速率减小。
(5)容器容积不变,充入氖气,由于反应物的浓度不变,所以反应速率是不变的。

练习册系列答案
相关题目
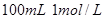 盐酸与锌粉反应,下列措施能使反应速率加快的是
盐酸与锌粉反应,下列措施能使反应速率加快的是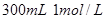 盐酸
盐酸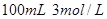 盐酸
盐酸
 2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是( )
2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是( )