题目内容
室温下,在pH为5的NH4Cl溶液、pH为9的NaHCO3溶液和pH为5的盐酸中,水的电离度分别为:α1、α2、α3,它们之间的大小关系是 ( )
| A.α1<α2<α3 | B.α1=α2>α3 | C.α1>α2>α3 | D.无法判断 |
B
盐类水解促进水的电离,酸、碱抑制水的电离。pH为5的NH4Cl溶液中,水电离出的c(H+)=10-5mol/L;pH为9的NaHCO3溶液中,水电离出的c(H+)=c(OH-)=10-5 mol/L;pH为5的盐酸中,水电离出的c(H+)=c(OH-)=10-9mol/L。所以,α1=α2>α3。

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
 H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
 H++OH-向右移动且溶液呈酸性的是( )
H++OH-向右移动且溶液呈酸性的是( )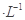 HA溶液中逐滴加入0.02mol
HA溶液中逐滴加入0.02mol
 ,醋酸银的溶度积
,醋酸银的溶度积 (CH3COOAg )=1.6×10
(CH3COOAg )=1.6×10 ,
,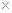 l0
l0 。在不考虑盐类水解的情况下,下列有关说法正确的是
。在不考虑盐类水解的情况下,下列有关说法正确的是 不变,故醋酸对水的电离无影响
不变,故醋酸对水的电离无影响 的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成
的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成