题目内容
下表是不同温度下水的离子积的数据:
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是_______________________________________________________。
(2)25 ℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)在t2温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a∶b=________。
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是_______________________________________________________。
(2)25 ℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)在t2温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a∶b=________。
(1)> 温度升高,水的电离程度增大,离子积增大 (2)1 000∶1 (3)碱 9∶11
(2)c(Na+)=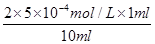 =1.0×10-4 mol·L-1,而25 ℃时水电离出来的c(OH-)=1.0×10-7 mol·L-1,所以c(Na+)∶c(OH-)=(1.0×
=1.0×10-4 mol·L-1,而25 ℃时水电离出来的c(OH-)=1.0×10-7 mol·L-1,所以c(Na+)∶c(OH-)=(1.0×
10-4)∶(1.0×10-7)=1 000∶1。(3)t2温度下,pH=6的溶液呈中性,则pH=7的溶液显碱性。若所得混合液pH=2,即酸过量,c(H+)=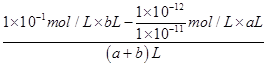 =1×10-2 mol·L-1,则a∶b=9∶11。
=1×10-2 mol·L-1,则a∶b=9∶11。
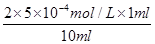 =1.0×10-4 mol·L-1,而25 ℃时水电离出来的c(OH-)=1.0×10-7 mol·L-1,所以c(Na+)∶c(OH-)=(1.0×
=1.0×10-4 mol·L-1,而25 ℃时水电离出来的c(OH-)=1.0×10-7 mol·L-1,所以c(Na+)∶c(OH-)=(1.0×10-4)∶(1.0×10-7)=1 000∶1。(3)t2温度下,pH=6的溶液呈中性,则pH=7的溶液显碱性。若所得混合液pH=2,即酸过量,c(H+)=
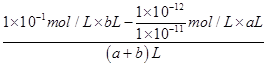 =1×10-2 mol·L-1,则a∶b=9∶11。
=1×10-2 mol·L-1,则a∶b=9∶11。
练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目

 O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1