题目内容
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
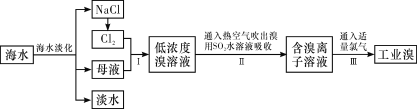
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是______________。写出步骤Ⅱ中发生反应的离子方程式:________________________________。
(3)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:__________________。
(4)已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的_____。(填选项)
A.![]() B.
B.![]() C.
C.![]() D.
D. ![]()
【答案】 BC 提高溴的富集程度 Br2+SO2+2H2O===4H+ +2Br-+SO42- 2NaCl(熔融)![]() 2Na+Cl2↑ C
2Na+Cl2↑ C
【解析】(1)要先除SO42-离子,然后再除Ca2+离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加NaOH除去Mg2+离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,然后过滤即可,最后加盐酸除去过量的氢氧根离子碳酸根离子;
(2) 步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,步骤Ⅱ中发生反应是二氧化硫吸收溴单质发生反应;
(3)制备钠单质的方法之一是将熔融NaCl进行电解;
(4)已知还原性I->Br->Cl-,反应后I-有剩余,说明Br-浓度没有变化,通入的Cl2只与I-发生反应,以此分析。
(1)要先除SO42-离子,然后再除Ca2+离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加NaOH除去Mg2+离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,然后过滤即可,最后加盐酸除去过量的氢氧根离子碳酸根离子,所以正确的操作顺序为:A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸,最后加入的氯化钡溶液中钡离子不能除去,故A错误;B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,故B正确;C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸,故C正确;D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸,顺序中加入的氯化钡溶液中钡离子无法除去,故D错误;故答案为:BC;
(2) 步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,步骤Ⅱ中发生反应是二氧化硫吸收溴单质发生反应,离子方程式为:Br2+SO2+2H2O===4H+ +2Br-+SO42-,
故答案为:提高溴的富集程度;Br2+SO2+2H2O===4H+ +2Br-+SO42-;
(3)制备钠单质的方法之一是将熔融NaCl进行电解,电解化学方程式为:2NaCl(熔融)![]() 2Na+Cl2↑,
2Na+Cl2↑,

【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO32- |
B |
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-lNaCl、NaI的混合溶液中滴加2滴0.01mol·L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-l NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D