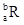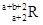题目内容
(12分)X、Y、Z、M、N为原子序数小于18的五种元素,X原子的电子层数等于最外层电子数;X与Y处于同一周期,Y与M可形成离子化合物M2Y,该化合物的水溶液显碱性;Z离子核内质子数与核外电子数之和为18;X、Z、M三种元素的离子具有相同的电子层排布;元素N的原子的质子、中子与电子数之和为2。
根据上述信息回答下列问题:
(1)写出质量数为32的Y原子符号____________,M2Y的电子式为________________。
(2)X、Z、M三种元素的离子半径大小顺序为_________________(用离子符号表示)。
(3)下列说法中正确的是___________________________。
(4)写出X、M两元素的最高价氧化物对应的水化物反应的离子方程式:
__________________________________________________________________________。
(5)已知(4)反应中生成的含X元素的化合物与HF、NaCl按l :6 :2的物质的量之比恰好完全反应,得到H2O、HCl和另一种含有三种元素且微溶于水的化合物,写出该反应的化学方程式__________________________________________________________。
根据上述信息回答下列问题:
(1)写出质量数为32的Y原子符号____________,M2Y的电子式为________________。
(2)X、Z、M三种元素的离子半径大小顺序为_________________(用离子符号表示)。
(3)下列说法中正确的是___________________________。
| A.元素Z与元素M形成的化合物中只有极性共价键和离子键 |
| B.元素M和元素N之间不能形成离子化合物 |
| C.元素X的原子比元素M的原子的失电子能力强 |
| D.元素Z与元素N形成的简单化合物比元素Y与元素N形成的化合物稳定 |
__________________________________________________________________________。
(5)已知(4)反应中生成的含X元素的化合物与HF、NaCl按l :6 :2的物质的量之比恰好完全反应,得到H2O、HCl和另一种含有三种元素且微溶于水的化合物,写出该反应的化学方程式__________________________________________________________。
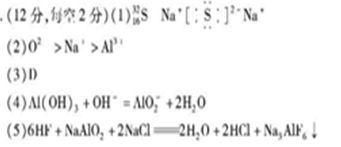
Z离子核内质子数与核外电子数之和为18,因为Z原子序数小于18,所以Z离子中可能有2个或10个或18个电子,其对应的质子数分别为16或8或0.其中成立的只有中间一组,即质子数为8,电子数为10,所以Z为氧。X原子的电子层数等于最外层电子数,其可能为H,Be,Al,又因为X、Z(氧)的离子具有相同的电子层排布,所以X为Al。X(铝)与Y处于同一周期,Y与M可形成离子化合物M2Y,该化合物的水溶液显碱性,所以M离子为强碱阳离子,Y离子为弱酸根离子。因为X(铝)、Z(氧)、M三种元素的离子具有相同的电子层排布,所以M为Na,则Y为S。原子的质子数和电子数相等,其和必为偶数,为2的整数倍,元素N的原子的质子、中子与电子数之和为2,所以N的中子数为0,质子数等于电子数等于2/2=1,所以N为H。总结:X(铝),Y(硫),Z(氧),M(钠),N(氢)。则第(1)问和第(4)问可得出答案。
(2)X、Z、M三种元素的离子具有相同的电子层排布,离子半径遵循“序小径大”的原则,则可得出答案。
(3)Z(氧)与M(钠)可形成过氧化钠,有非极性共价键,所以A错。M(钠)和N(氢)可形成氢化钠离子化合物,B错。X(铝)与M(钠)比较,M(钠)与X(铝)在同一周期,M(钠)位于X(铝)的左边,所以M(钠)失电子能力强于X(铝),C错。氧元素与硫元素在同一主族,氧元素在上边,所以氧的非金属性比硫强,所以H2O比H2S稳定,D对。
(5)中, NaAlO2与HF、NaCl 按l :6 :2的物质的量之比恰好完全反应,得到H2O、HCl和另一种含有三种元素,根据元素守恒和原子守恒,含有三种元素的物质为Na3AlF6,再根据原子守恒配平H2O、HCl即可。
(2)X、Z、M三种元素的离子具有相同的电子层排布,离子半径遵循“序小径大”的原则,则可得出答案。
(3)Z(氧)与M(钠)可形成过氧化钠,有非极性共价键,所以A错。M(钠)和N(氢)可形成氢化钠离子化合物,B错。X(铝)与M(钠)比较,M(钠)与X(铝)在同一周期,M(钠)位于X(铝)的左边,所以M(钠)失电子能力强于X(铝),C错。氧元素与硫元素在同一主族,氧元素在上边,所以氧的非金属性比硫强,所以H2O比H2S稳定,D对。
(5)中, NaAlO2与HF、NaCl 按l :6 :2的物质的量之比恰好完全反应,得到H2O、HCl和另一种含有三种元素,根据元素守恒和原子守恒,含有三种元素的物质为Na3AlF6,再根据原子守恒配平H2O、HCl即可。

练习册系列答案
相关题目