题目内容
【题目】黑火药是中国古代四大发明之一,它的爆炸反应为:
2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)生成物A的电子式为:__________________,属于______________晶体。
(2)黑火药中位于短周期的元素有_________种。其中有一种元素的单质可制药,其氧化物可做防腐剂,该元素在周期表中的位置是_________,该元素的原子核外有_______种不同运动状态的电子。
(3)黑火药所含元素中原子半径从大到小的顺序是______________(用元素符号表示);
(4)下列能说明黑火药中碳与硫两元素非金属性相对强弱的有___________________。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价 D.加热分解温度:CH4>H2S
【答案】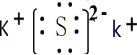 离子 四 第三周期第VIA族 16 K>S>C>N>O AC
离子 四 第三周期第VIA族 16 K>S>C>N>O AC
【解析】
(1)由原子守恒可知,A为K2S,为离子化合物;
(2)C、N、O、S、K中,氧化物可用于漂白织物和防腐剂,为S的氧化物,S的原子核外电子数为16;
(3)电子层越多,半径越大;同周期原子序数大的半径小;
(4)A.元素最高价氧化物对应水化物的酸性越强,则元素的非金属性越强;
B.亚硫酸不是硫元素的最高价氧化物对应的水化物;
C.非金属性强的元素显示负价,非金属性弱的则显示正价;
D.一般来说,元素的气态氢化物越稳定,则元素的非金属性越强。
(1)由原子守恒可知,A为K2S,只含离子键,为离子晶体,其电子式为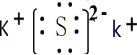 ;
;
(2)黑火药中位于短周期的元素有C、N、O、S,氧化物可用于漂白织物和防腐剂,为S的氧化物,S位于第三周期第VIA族,S的原子核外电子数为16,则有16种不同运动状态的电子;
(3)电子层越多,半径越大;同周期原子序数大的半径小,则原子半径由大到小为K>S>C>N>O;
(4)A.Na2CO3水解呈碱性,说明H2CO3是弱酸,Na2SO4不水解,H2SO4是强酸,所以H2SO4的酸性强于H2CO3的,则能说明碳与硫两元素非金属性为S>C,故A选;
B.亚硫酸强于碳酸,说明亚硫酸电离出氢离子的能力强于硫酸,不能说明碳与硫两元素非金属性相对强弱,故B不选;
C.直接说明S的非金属性强于C,所以S才显负价,碳元素显示正价,故C选;
D.氢化物的稳定性顺序是CH4>H2S,但S的非金属性强于碳元素,故D不选;
故答案为:AC。

 小学教材完全解读系列答案
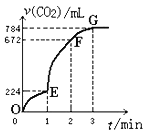
小学教材完全解读系列答案【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=_____。已知:K(300℃)>K(350℃),则该反应正反应是_________热反应。升高温度,正反应速率_______(填“增大”、“减小”或“不变”)。
(2)下图中表示NO2的变化的曲线是____。用O2表示从0~2 s内该反应的平均速率v(O2)=______。
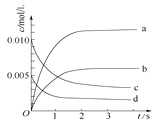
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂