题目内容
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________:
(2)过程I 加入铁屑的主要作用是___________,分离得到固体的主要成分是______,从固体中分离出铜需采用的方法是___________________;
(3)过程II中发生反应的化学方程式为_________________________;
(4)过程II中调节溶液的pH为5,金属离子浓度为__________________。(列式计算)
【答案】2Fe3++Cu = 2Fe2++Cu2+ )回收铜 Cu和Fe 加盐酸反应后过滤 FeCl2+Ca(OH)2 =Fe(OH)2↓+CaCl2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Ksp=c(Fe3+)·c3(OH-),pH为5,c(H+)=10-5,c(OH-)=![]() =10-9mol/L,所以c(Fe3+)=
=10-9mol/L,所以c(Fe3+)=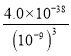 = 4.0×10-11 (mol/L)
= 4.0×10-11 (mol/L)
【解析】
(1)氯化铁和铜反应生成氯化亚铁和氯化铜,依据离子方程式书写方法写出;
(2)过程Ⅰ加入铁屑的主要作用是和氯化铜发生反应生成铜,过滤后得到固体为Fe和Cu,加入盐酸铁反应,铜不反应过滤分离得到铜;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;
(4)过程Ⅱ中调节溶液的pH为,氢氧化铁沉淀溶液中存在沉淀溶解平衡,依据溶度积常数计算。由Ksp=c(Fe3+)·c3(OH-),c(OH-)=![]() ,可求得c(Fe3+)。
,可求得c(Fe3+)。
(1)FeCl3蚀刻铜箔反应是三价铁离子具有氧化性和铜反应生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)向废液中投入过量铁屑,铁会和三氯化铁溶液反应生成氯化亚铁,和氯化铜反应生成铜和氯化亚铁,所以加入铁粉是为了得到铜,过滤得到固体是过量的铁和铜,用盐酸溶解铁反应,铜不反应过滤得到铜;
故答案为:回收铜;铁和铜;加盐酸反应后过滤;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;反应的化学方程式为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 ,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)过程Ⅱ中调节溶液的pH为5,常温下溶液中氢氧根离子浓度为10-9mol/L,依据溶度积常数计算铁离子浓度,Fe(OH)3(s)Fe3++3OH-;Ksp=c(Fe3+)×c3(OH-);c(H+)=10-5,c(OH-)=![]() =10-9mol/L,c(Fe3+)=
=10-9mol/L,c(Fe3+)=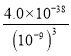 =4×10-11mol/L;
=4×10-11mol/L;
故答案为:4×10-11mol/L。