题目内容
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:
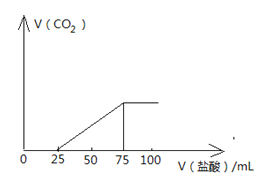
(1)原NaOH溶液的物质的量浓度为 ;
(2)题中通入CO2后所得溶液的溶质成分为 ,
若将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为 g
【答案】(1)1.5mol/L;(2)Na2CO3;NaHCO3;9.5g
【解析】
试题分析:(1)加入75mL盐酸时,二氧化碳的体积最大,此时,溶液中的溶质全部为NaCl,根据Na原子和Cl原子守恒,可知,![]() ,则原NaOH溶液的物质的量浓度为:
,则原NaOH溶液的物质的量浓度为:![]() ;(2)向NaOH溶液中通入CO2气体,可能发生的反应为:NaOH + CO2 = NaHCO3 或 2NaOH + CO2 = Na2CO3 + H2O;由于开始加入盐酸时,并无气体生成,因此题中通入CO2后所得溶液的溶质成分为Na2CO3和NaHCO3;通入盐酸25mL之前,Na2CO3和盐酸反应生成NaHCO3,方程式为:Na2CO3 + HCl = NaHCO3 + NaCl ,则Na2CO3的物质的量为:
;(2)向NaOH溶液中通入CO2气体,可能发生的反应为:NaOH + CO2 = NaHCO3 或 2NaOH + CO2 = Na2CO3 + H2O;由于开始加入盐酸时,并无气体生成,因此题中通入CO2后所得溶液的溶质成分为Na2CO3和NaHCO3;通入盐酸25mL之前,Na2CO3和盐酸反应生成NaHCO3,方程式为:Na2CO3 + HCl = NaHCO3 + NaCl ,则Na2CO3的物质的量为:![]() ,因此反应生成的NaHCO3的物质的量为0.05mol;加入25mL盐酸以后,NaHCO3和盐酸反应生成NaCl、水和二氧化碳,反应的方程式为:NaHCO3 + HCl = NaCl + H2O + CO2 ↑,因此NaHCO3的总的物质的量为:
,因此反应生成的NaHCO3的物质的量为0.05mol;加入25mL盐酸以后,NaHCO3和盐酸反应生成NaCl、水和二氧化碳,反应的方程式为:NaHCO3 + HCl = NaCl + H2O + CO2 ↑,因此NaHCO3的总的物质的量为:![]() ,因此溶液中原有的NaHCO3的物质的量为0.5mol,将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为
,因此溶液中原有的NaHCO3的物质的量为0.5mol,将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为![]() 。
。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目