题目内容
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)A的元素符号______________,D的元素名称 ____________。
(2)C在周期表中的位置为第______周期______族,E的离子结构示意图________;
(3)B、C、E分别与A形成的化合物中最稳定的是________(写化学式);E、F的最高价氧化物对应的水化物的酸性较强的是________(写化学式)
(4)F的单质在反应中常作氧化剂,该单质的水溶液与E的低价氧化物反应的离子方程式为________________。
(5)X在纯净的C单质中可以安静的燃烧,生成B的单质。该方应的化学方程式为:__________________。
【答案】 H 铝 2 ⅥA 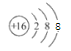 H2O HClO4 SO2 + Cl2 + 2H2O =2Cl-+4H++SO42- 4NH3+3O2(纯氧)
H2O HClO4 SO2 + Cl2 + 2H2O =2Cl-+4H++SO42- 4NH3+3O2(纯氧)![]() 2N2+6H2O
2N2+6H2O
【解析】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性,所以X为NH3,A的原子序数比B小,则B为N元素,A为H元素;D的简单阳离子与X具有相同电子数,NH3含有10个电子,D的简单阳离子为10e-结构,且D是同周期中简单离子半径最小的元素,则D为Al元素;E元素的原子最外层比次外层少两个电子,E的原子序数大于Al,则E有3个电子层,最外层电子数为6,则E为S元素;F的原子序数比E大且为短周期主族元素,则F是Cl元素;C、F两种元素的原子最外层共有13个电子,C最外层有6个电子,原子序数比Na小,则C为O元素,则
(1)A的元素符号H,D的元素名称铝;(2)O在周期表中的位置为第二周期第ⅥA族,S2-的离子结构示意图为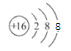 ;(3)N、O、S三元素中O的非金属性最强,故分别与H形成的化合物中最稳定的是H2O;非金属性Cl>S,则E、F的最高价氧化物对应的水化物的酸性较强的是HClO4;(4)氯气与SO2在溶液中反应的离子方程式为SO2 + Cl2 + 2H2O =2Cl-+4H++SO42-;(5)氨气在纯氧中燃烧生成氮气和水的方程式为4NH3+3O2(纯氧)
;(3)N、O、S三元素中O的非金属性最强,故分别与H形成的化合物中最稳定的是H2O;非金属性Cl>S,则E、F的最高价氧化物对应的水化物的酸性较强的是HClO4;(4)氯气与SO2在溶液中反应的离子方程式为SO2 + Cl2 + 2H2O =2Cl-+4H++SO42-;(5)氨气在纯氧中燃烧生成氮气和水的方程式为4NH3+3O2(纯氧)![]() 2N2+6H2O。
2N2+6H2O。

 名校课堂系列答案
名校课堂系列答案