题目内容
已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓)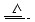 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于 (用字母代号填写)
A.酸 B.碱 C.盐 D.酸性氧化物 E.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中 (填写化学式,下同)失去电子,氧化剂是 。
(2)若A物质通入品红溶液,观察到溶液褪色,说明A物质具有 (填序号,下同);若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
A.氧化性 B.还原性 C.漂白性
若A物质通入双氧水,请大胆判断所得溶液是 (填溶质的化学式)
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为 L (假设气体全部逸出)。若用4 mol·L-1的NaOH溶液吸收生成的A,并生成正盐,写出发生的反应方程式 计算需要NaOH溶液的体积 L。
Cu+2H2SO4(浓)
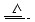 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于 (用字母代号填写)
A.酸 B.碱 C.盐 D.酸性氧化物 E.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中 (填写化学式,下同)失去电子,氧化剂是 。
(2)若A物质通入品红溶液,观察到溶液褪色,说明A物质具有 (填序号,下同);若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
A.氧化性 B.还原性 C.漂白性
若A物质通入双氧水,请大胆判断所得溶液是 (填溶质的化学式)
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为 L (假设气体全部逸出)。若用4 mol·L-1的NaOH溶液吸收生成的A,并生成正盐,写出发生的反应方程式 计算需要NaOH溶液的体积 L。
(1)D;SO2;KMnO4 (2)C;A;H2SO4。
(3)2.24;2NaOH + SO2 =Na2SO3 + H2O;0.05
(3)2.24;2NaOH + SO2 =Na2SO3 + H2O;0.05
试题分析:(1)铜和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O。SO2属于酸性氧化物。因此选项为D。SO2可以使酸性KMnO4溶液褪色,是由于发生反应:2KMnO4+ 5SO2+2H2O=K2SO4+2MnSO4+2H2SO4。在此反应中,SO2失去电子,作还原剂;KMnO4得到电子,作氧化剂,表现氧化性。(2)若SO2通入品红溶液,观察到溶液褪色,是因为SO2有漂白性。若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,是因为发生反应:SO2+H2O=H2SO3. H2SO3+Na2S=Na2SO3+H2S;SO2+2H2S="3S↓+" 2H2O. 说明SO2具有氧化性。若将SO2通入双氧水中,则发生氧化还原反应:SO2+H2O2=H2SO4,产生硫酸。(3)铜和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O。SO2属于酸性氧化物。因此选项为D。SO2可以使酸性KMnO4溶液褪色,是由于发生反应:2KMnO4+ 5SO2+2H2O=K2SO4+2MnSO4+2H2SO4。在此反应中,SO2失去电子,作还原剂;KMnO4得到电子,作氧化剂,表现氧化性。(2)若SO2通入品红溶液,观察到溶液褪色,是因为SO2有漂白性。若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,是因为发生反应:SO2+H2O=H2SO3. H2SO3+Na2S=Na2SO3+H2S;SO2+2H2S="3S↓+" 2H2O. 说明SO2具有氧化性。若将SO2通入双氧水中,则发生氧化还原反应:SO2+H2O2=H2SO4,产生硫酸。(3)铜和浓硫酸反应的化学方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,在反应方程式中,每产生1mol的SO2气体,电子转移2mol.。现在电子转移了0.2mol,所以产生了0.1mol的SO2气体。在标准状况下,其体积为2.24L。若用4 mol·L-1的NaOH溶液吸收生成的SO2,并生成正盐,则该反应的反应方程式为2NaOH + SO2 =Na2SO3 + H2O。n(NaOH)=2n(SO2)=0.2mol。V(NaOH)=n÷c=0.2mol÷4mol/L=0.05L.2气体的实验室制法、性质及有关反应的计算的知识。
CuSO4+SO2↑+2H2O,在反应方程式中,每产生1mol的SO2气体,电子转移2mol.。现在电子转移了0.2mol,所以产生了0.1mol的SO2气体。在标准状况下,其体积为2.24L。若用4 mol·L-1的NaOH溶液吸收生成的SO2,并生成正盐,则该反应的反应方程式为2NaOH + SO2 =Na2SO3 + H2O。n(NaOH)=2n(SO2)=0.2mol。V(NaOH)=n÷c=0.2mol÷4mol/L=0.05L.2气体的实验室制法、性质及有关反应的计算的知识。
练习册系列答案
相关题目
 4Na[Au(CN)2]+4NaOH;
4Na[Au(CN)2]+4NaOH; 2H++CO32-
2H++CO32-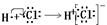
 2CrO42-(黄色) +2H+
2CrO42-(黄色) +2H+ HCOONa+H2O,下列有关说法不正确的是( )
HCOONa+H2O,下列有关说法不正确的是( )