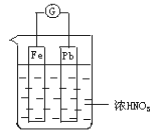
题目内容
(7分)一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。。
(1)该电池反应的总离子方程式为____________________________________________;
(2)甲醇在_________极发生反应(填正或负),电池在放电过程中溶液的pH将__________(填降低或上升、不变);
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①放电时固体电解质里的O2-离子的移动方向是向____________极移动(填正或负)。
②电池的正极反应式为____________________________________________ 。
(1)该电池反应的总离子方程式为____________________________________________;
(2)甲醇在_________极发生反应(填正或负),电池在放电过程中溶液的pH将__________(填降低或上升、不变);
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①放电时固体电解质里的O2-离子的移动方向是向____________极移动(填正或负)。
②电池的正极反应式为____________________________________________ 。
(1)2CH3OH+3O2+4OH-=2CO32-+6H2O_(2分)
(2) 负(1分), 下降(1分)
(3) 负(1分), O2+4e-=2O2-(2分)。
(2) 负(1分), 下降(1分)
(3) 负(1分), O2+4e-=2O2-(2分)。
试题分析:(1)负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,正极上氧气得电子和水反应生成氢氧根离子,电极反应式3/2O2+3H2O+6e-=6OH-,则总反应为2CH3OH+3O2+4OH- = 2CO32-+6H2O;
(2)负极上燃料发生电极反应,甲醇在负极反应;放电时消耗氢氧根离子,pH降低。
(3)因为燃料被氧化,需要结果氧离子,所以氧离子向负极移动,正极氧气转化为氧离子,方程式为:O2+4e-=2O2-。
点评:本题以燃料电池为载体考查了原电池原理,根据电池反应式判断正负极上发生反应的物质及电极附近溶液PH值的变化即可解答本题,难度较大。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
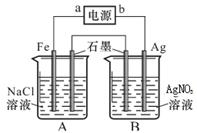
 2CO32-+6H2O,则下列说法不正确的是 ( )
2CO32-+6H2O,则下列说法不正确的是 ( )