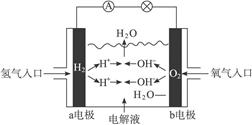
题目内容
在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的氢气时,硫酸恰好用完,则:
(1)产生这些气体消耗的锌的质 量是多少?
(2)通过导线的电子的物质的量是多少?
(3)原稀硫酸的物质的量浓度是多少?
(1)产生这些气体消耗的锌的质 量是多少?
(2)通过导线的电子的物质的量是多少?
(3)原稀硫酸的物质的量浓度是多少?
(1)9.75 g (2)0.3 mol (3)0.75 mol/L
试题分析:(1)氢气的物质的量是3.36L÷22.4L/mol=0.15mol
则根据反应的化学方程式可知
Zn + H2SO4=ZnSO4+H2↑
1mol 1mol 1mol
0.15mol 0.15mol 0.15mol
所以消耗锌的质量是0.15mol×65g/mol=9.75mol
(2)转移电子的物质的量是0.15mol×2=0.3mol
(3)原稀硫酸的浓度是0.15mol÷0.2L=0.75mol/L
点评:该题是基础性试题的考查,难度不大。主要是考查学生对原电池原理的了解、掌握程度,有利于培养学生的逻辑推理能力和规范答题能力,提高学生分析问题、解决问题的能力。

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目


 2SO3(g) ΔH<0”的平衡常数K正、K
2SO3(g) ΔH<0”的平衡常数K正、K

 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)  NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是