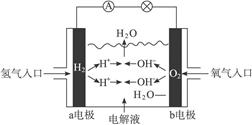
题目内容
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。试依次写出Fe电极上可能发生的电极反应式:____________、___________(可不填满,也可补充)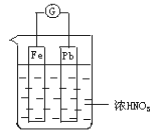

4H++2NO3—+2e-=2NO2↑+2H2O、Fe-2e-=Fe2+
由于浓硝酸能使铁方式钝化,所以开始阶段,铁电极是正极,铅是负极;随着反应的进行,硝酸的浓度逐渐降低,而稀硝酸能溶解铁,所以后阶段,铁又是负极,铅是正极。有关的方程式是4H++2NO3—+2e-=2NO2↑+2H2O、Fe-2e-=Fe2+。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目