题目内容
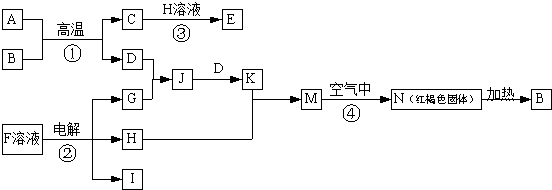
3.如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去.反应①常被应用于野外焊接钢轨,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液.
请回答下列问题:
(1)A中含有的元素在周期表中的位置第三周期,第ⅢA族.
(2)B的化学式为Fe2O3.
(3)H的电子式
 .
.(4)写出反应③的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)写出反应④的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 反应①常被应用于野外焊接钢轨,应为金属铝和氧化铁发生铝热反应,方程式为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,则A为Al,B为Fe2O3,反应②在工业上被称为氯碱工业,F应为NaCl,电解生成NaOH、H2和Cl2,氯碱工业中电解NaCl溶液,生成NaOH、H2和Cl2,反应的方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,N为红褐色固体,应为Fe(OH)3,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2,结合物质的性质解答该题.
解答 解:反应①常被应用于野外焊接钢轨,应为金属铝和氧化铁发生铝热反应,方程式为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,则A为Al,B为Fe2O3,反应②在工业上被称为氯碱工业,氯碱工业中电解NaCl溶液,生成NaOH、H2和Cl2,反应的方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,F应为NaCl,电解生成NaOH、H2和Cl2,N为红褐色固体,应为Fe(OH)3,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2,
(1)A中含有的元素为铝元素,在周期表中的位置是第三周期,第ⅢA族,
故答案为:第三周期,第ⅢA族;
(2)由上面的分析可知,B的化学式为Fe2O3,故答案为:Fe2O3;
(3)H为NaOH,它的电子式为  ,故答案为:
,故答案为: ;
;
(4)反应③为Al2O3和NaOH的反应,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(5)反应④为氢氧化亚铁氧化生成氢氧化铁,反应化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,可观察到白色沉淀迅速变为灰绿色,最终变为红褐色,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查无机物的推断,题目难度较大,本题注意把握物质的反应特征、物质的本身特性以及工业反应为突破口进行推断,明确物质的种类为解答该题的关键.

| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 原溶液中有Na+,无K+ |
| B | 向醋酸钠溶液中滴入酚酞试液,加热后若红色加深 | 证明盐类的水解是吸热反应 |
| C | 向CH2=CHCHO中滴入KMnO4酸性溶液,紫红色褪去 | 证明CH2=CHCHO中含有碳碳双键 |
| D | 硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
| A. | A | B. | B | C. | C | D. | D |
| A. | ${\;}_{77}^{191}$Ir的质子数为191 | |
| B. | ${\;}_{77}^{191}$Ir和${\;}_{77}^{193}$Ir互为同位素 | |
| C. | ${\;}_{77}^{191}$Ir和${\;}_{77}^{193}$Ir的中子数相同 | |
| D. | ${\;}_{77}^{193}$Ir的核外电子数为116 |
| A. | 12C和14C | B. | O2和O3 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | 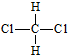 和 和 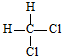 |
| A. | 淀粉 | B. | 纤维素 | C. | 氯乙烯 | D. | 蛋白质 |
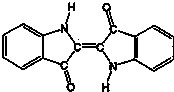
| A. | 该物质是高分子化合物 | B. | 它的分子式是C15H10N2O2 | ||
| C. | 靛蓝由碳、氢、氧、氮四种元素组成 | D. | 它是不饱和的有机物 |
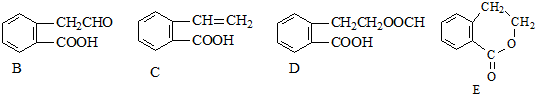
 ,它可通过不同化学反应分别制得如图B、C、D和E四种物质.
,它可通过不同化学反应分别制得如图B、C、D和E四种物质. ,反应类型:氧化反应
,反应类型:氧化反应 +H2O,反应类型:酯化反应或取代反应
+H2O,反应类型:酯化反应或取代反应 .
.