题目内容
11.铱铂合金因膨胀系数极小,常用来制造国际标准米尺.铱有两种自然稳定同位素:铱-191(${\;}_{77}^{191}$Ir)和铱-193(${\;}_{77}^{193}$Ir).下列有关说法中正确的是( )| A. | ${\;}_{77}^{191}$Ir的质子数为191 | |
| B. | ${\;}_{77}^{191}$Ir和${\;}_{77}^{193}$Ir互为同位素 | |
| C. | ${\;}_{77}^{191}$Ir和${\;}_{77}^{193}$Ir的中子数相同 | |
| D. | ${\;}_{77}^{193}$Ir的核外电子数为116 |
分析 根据原子符号中,左下脚的数字为质子数,左上角的数字为质量数,中子数=质量数-质子数,质子数=核外电子数,以及同位素的概念分析.
解答 解:A、${\;}_{77}^{191}$Ir的质子数为77,质量数为191,故A错误;
B、${\;}_{77}^{191}$Ir和${\;}_{77}^{193}$Ir质子数相同中子数不同,是同种元素的不同原子互为同位素,故B正确;
C、${\;}_{77}^{191}$Ir和${\;}_{77}^{193}$Ir质子数相同中子数不同,中子数分别为114、116,故C错误;
D、${\;}_{77}^{193}$Ir的质子数与核外电子数相同,核外电子数为77,故D错误;
故选B.
点评 本题考查了原子结构、同位素的概念,注意对原子序数=质子数=核外电子数的知识理解与掌握,属基础性知识考查题.

练习册系列答案
相关题目
1.近期我国中东部地区连续多日出现阴霾均系环境污染造成的,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的.下列环境问题与所对应的物质不相关的是( )
| A. | 温室效应--CO2 | B. | 光化学污染--NO2 | C. | 酸雨--SO2 | D. | 臭氧层破坏--CO |
2.已知2A(g)+B(g)?2C(g)△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A和1mol B,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量为b kJ.
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”“=”或“<”).
若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度=(填“>”、“=”或“<”)w mol/L,a、b、c之间满足何种关系a=b+c(用代数式表示).
(2)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是D.
A.4mol A和2mol B B.4mol A、2mol B和2mol C
C.4mol A和4mol B D.6mol A和4mol B
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C气体 B.适当升高温度C.增大B的浓度 D.选择高效催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A和1mol B,500℃时充分反应达平衡后,放出热量为d kJ,则d>b(填“>”“=”或“<”).
(5)在一定温度下,向一个容积可变的容器中,通入3mol A和2mol B及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol A、3mol B和2mol C,则平衡时A的百分含量不变(填“不变”“变大”“变小”或“无法确定”).
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”“=”或“<”).
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(2)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是D.
A.4mol A和2mol B B.4mol A、2mol B和2mol C
C.4mol A和4mol B D.6mol A和4mol B
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C气体 B.适当升高温度C.增大B的浓度 D.选择高效催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A和1mol B,500℃时充分反应达平衡后,放出热量为d kJ,则d>b(填“>”“=”或“<”).
(5)在一定温度下,向一个容积可变的容器中,通入3mol A和2mol B及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol A、3mol B和2mol C,则平衡时A的百分含量不变(填“不变”“变大”“变小”或“无法确定”).
19.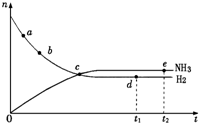 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d (t1时刻)和点e (t2时刻)处n (N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大 |
16.下列反应不属于取代反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| B. | 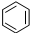 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$ +H2O +H2O | |
| C. | CH3CH2OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH2=CH2+HBr→CH3CH2Br |
1.分子式为C4H802的酯共有(不考虑立体异构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |

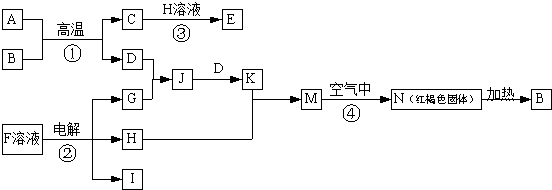
 .
.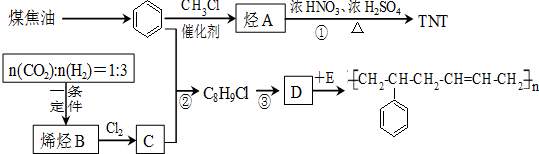
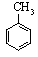 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$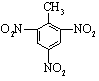 +3H2O.
+3H2O.