题目内容
7.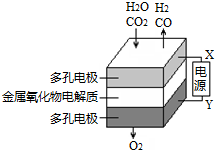 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2e-═H2+O2-,CO2+2e-═CO+O2- | |
| C. | 总反应可表示为:H2O+CO2$\frac{\underline{\;通电\;}}{\;}$H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
分析 A.电解池阳极发生氧化反应,阴极发生还原反应,根据与X极相连的电极产生的气体判断;
B.电解池阴极发生还原反应,根据反应物结合化合价的变化分析;
C.根据图示以及电解的目的解答;
D.根据图示知:阴极产生H2、CO,阳极产生氧气,结合C总的反应分析;
解答 解:A.根据图示知:与X相连的电极产生CO,电解H2O-CO2混合气体,二氧化碳得到电子生成一氧化碳,发生还原反应,电解池阴极发生还原反应,所以X是电源的负极,故A正确;
B.电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳,CO2+2e-═CO+O2-,故B正确;
C.电解H2O-CO2混合气体制备H2和CO,根据图示知:阴极产生H2、CO,阳极产生氧气,所以总反应为:H2O+CO2$\frac{\underline{\;通电\;}}{\;}$H2+CO+O2,故C正确;
D.电解H2O-CO2混合气体制备H2和CO,总反应为:H2O+CO2$\frac{\underline{\;通电\;}}{\;}$H2+CO+O2,阴极产生H2、CO,阳极产生氧气,阴、阳两极生成的气体的物质的量之比是2:1,故D错误;
故选D.
点评 本题考查电解知识,为高频考点,侧重于考查学生的综合运用能力,题目难度中等,注意基础知识的积累掌握,掌握电解池阳极发生氧化反应,阴极发生还原反应为解答关键.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
2.研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).

①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液PH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$.
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).

①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液PH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
12.某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.
实验(一) 碘含量的测定

取0.0100mol•L-1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E) 反映溶液中c(I-)的变化,部分数据如表:
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH═5NaI+NaIO3+3H2O
请回答:
(1)实验(一)中的仪器名称:仪器A坩埚,仪器B500mL容量瓶.
(2)①根据表中数据绘制滴定曲线:
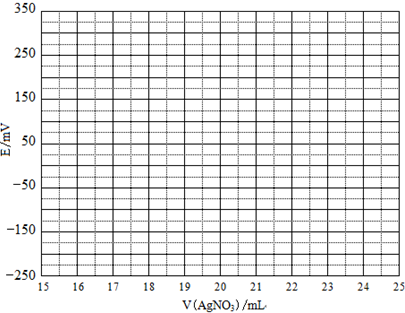
②该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为0.635%%.
(3)①分液漏斗使用前须检漏,检漏方法为向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水.
②步骤X中,萃取后分液漏斗内观察到的现象是液体分为上下两层,下层呈紫红色.
③下列有关步骤Y的说法,正确的是AB.
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是过滤.
(4)方案甲中采用蒸馏不合理,理由是碘单质易升华,会导致碘损失.
实验(一) 碘含量的测定

取0.0100mol•L-1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E) 反映溶液中c(I-)的变化,部分数据如表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH═5NaI+NaIO3+3H2O
请回答:
(1)实验(一)中的仪器名称:仪器A坩埚,仪器B500mL容量瓶.
(2)①根据表中数据绘制滴定曲线:

②该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为0.635%%.
(3)①分液漏斗使用前须检漏,检漏方法为向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水.
②步骤X中,萃取后分液漏斗内观察到的现象是液体分为上下两层,下层呈紫红色.
③下列有关步骤Y的说法,正确的是AB.
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是过滤.
(4)方案甲中采用蒸馏不合理,理由是碘单质易升华,会导致碘损失.
14.被誉为“矿石熊猫”的香花石,由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法错误的是( )
| A. | 原子半径:Y>Z>R>T | |
| B. | 气态氢化物的稳定性:W<R<T | |
| C. | 最高价氧化物对应的水化物的碱性:X>Z | |
| D. | XR2、WR2两种化合物中R的化合价相同 |
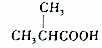 的官能团为-COOH;在0.1mol/L该酸的水溶液中就1滴酚酞试液,溶液呈无色.
的官能团为-COOH;在0.1mol/L该酸的水溶液中就1滴酚酞试液,溶液呈无色.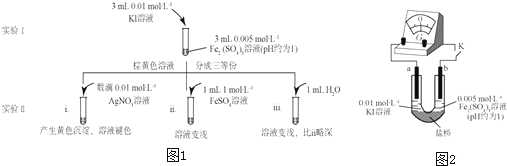
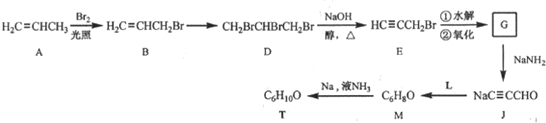
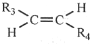 ,则T的结构简式为
,则T的结构简式为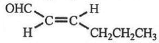 .
.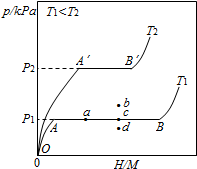 合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.