题目内容
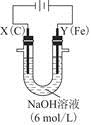
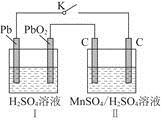
(2014届江西省景德镇市高三第一次模拟考试卷理综化学试卷)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+ PbO2(s)+2H2SO4(aq)= 2PbSO4(s)+ 2H2O(l)
电解池:2Al + 3H2O Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
电解池:2Al + 3H2O
 Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )| | 原电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D | 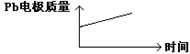 | 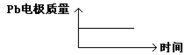 |
D
A.根据同种电荷相互排斥,异种电荷相互吸引的原则,在原电池中,H+移向PbO2电极;在电解池H+移向Pb电极。错误。B.每消耗3molPb,电子转移6mol,由于在同一闭合回路中电子转移数目相等。所以在电解池中生成1molAl2O3.错误。C. 在原电池的正极发生反应PbO2+4H++2e-+SO42-=PbSO4+2H2O;在电解池阳极:2Al+3H2O-6e-=Al2O3+6H+。错误。D.在原电池中由于负极的变化为Pb→PbSO4.所以Pb电解质量增加。在电解池中,Pb作阴极,不参与氧化还原反应,所以其质量不发生变化。正确。

练习册系列答案
相关题目


 Cu2O + H2↑。
Cu2O + H2↑。
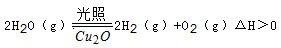
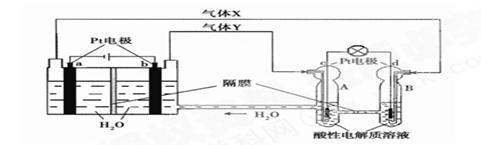
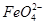 。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
。实验过程中,两极均有气体产生,Y极区溶液逐渐生成