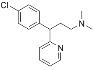
题目内容
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 0.3 mol·L-1A1(NO3)3溶液中含A13+数小于0.3 NA
B. H2(g)+I2(g)![]() 2HI(g) △H= - akJ·mol-1,向密闭容器中加入NA个氢分子和NA个碘分子,充分反应后放出的热量为akJ
2HI(g) △H= - akJ·mol-1,向密闭容器中加入NA个氢分子和NA个碘分子,充分反应后放出的热量为akJ
C. 常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为1.5NA
D. 标准状况下, Zn│H2SO4(1mol·L-1)│Cu原电池中,正极产生1.12 L H2时,转移的电子数为0.1NA
【答案】D
【解析】
A. 若为1L、0.3molL-1的AlCl3溶液中,由于Al3+水解,含Al3+的数目小于0.3NA,由于溶液体积未知,无法计算并判断所含Al3+的数目,故A错误;
B. 该反应为可逆反应,NA个氢分子和NA个碘分子,不可能完全反应生成2molHI(g),故放出的热量比akJ少,故B错误;
C. C2H4、CO的摩尔质量都是28g/mol,混合气体28g,物质的量为1mol,含有碳原子数目与二者的比例关系有关,当二者物质的量为1:1时,含有碳原子的数目为1.5NA,故C错误;
D. 用锌、铜作电极,铜为原电池的正极,电解质为硫酸,正极反应为2H++2e-=H2↑,
n(H2)=![]() =0.05mol,则H+得到0.05mol
=0.05mol,则H+得到0.05mol![]() 2=0.1mol电子,即转移的电子数为0.1NA,故D正确。
2=0.1mol电子,即转移的电子数为0.1NA,故D正确。
故选D。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目