题目内容
【题目】按化学反应中元素化合价是否发生变化,无机反应可以分为氧化还原反应和非氧化还原反应。这种分类方法与将无机反应按反应形式的不同分为四种基本反应类型是完全不同的分类方式,这二者的关系如图。

图中方框内区域表示所有的化学反应,大圆内区域表示氧化还原反应,大圆外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型。请分别填出:
(1)化学反应可以分为哪四种基本反应类型:___、___、___、___。
(2)若图中B圈表示化合反应,则:
B圈与氧化还原反应重叠的阴影部分表示哪一类反应?___________;
C圈与氧化还原反应重叠的阴影部分表示哪一类反应?______________;
请分别举出符合以上两种情况的一个例子:________; ___________。
(3)下列说法正确的是___。
A.置换反应一定属于氧化还原反应
B.有单质参加和有单质生成的化学反应一定是氧化还原反应
C.化学反应中有一种物质被氧化,必定有另外一种物质被还原
D.氧化还原反应发生的本质是化合价发生了变化
【答案】化合反应 分解反应 置换反应 复分解反应 有元素化合价变化的化合反应 有元素化合价变化的分解反应 Cl2+2FeCl2=2FeCl3 2KClO3![]() 2KCl+3O2↑ A
2KCl+3O2↑ A
【解析】
(1)置换反应一定属于氧化还原反应,复分解反应一定不属于氧化还原反应,有元素化合价变化的分解反应属于氧化还原反应,有元素化合价变化的化合反应属于氧化还原反应;
(2)B、C圈表示既属于氧化还原反应又属于化合反应或分解反应的反应;
(3)A.置换反应一定有化合价变化,则属于氧化还原反应;
B.同素异形体之间的转化有单质生成或有单质参加,但无化合价变化;
C.氧化还原反应可发生在同一物质之间;
D.氧化还原反应发生的本质是电子转移。
(1)置换反应一定属于氧化还原反应,复分解反应一定不属于氧化还原反应,有元素化合价变化的分解反应属于氧化还原反应,有元素化合价变化的化合反应属于氧化还原反应,所以化合反应和分解反应与氧化还原反应属于交叉关系,置换反应被氧化还原反应包含,复分解反应和氧化还原反应既不交叉也不被包含,若B表示化合反应,则C表示分解反应,A表示置换反应,D表示复分解反应;
(2)B圈与氧化还原反应重叠的阴影部分表示既是氧化还原反应又是化合反应,则为有元素化合价变化的化合反应,如:Cl2+2FeCl2=2FeCl3;C圈与氧化还原反应重叠的阴影部分表示既是分解反应又是氧化还原反应,则为有元素化合价变化的分解反应,如:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)A.置换反应一定有化合价变化,属于氧化还原反应,A正确;
B.同素异形体之间的转化有单质生成或有单质参加,但无元素化合价变化,不属于氧化还原反应,B错误;
C.氧化还原反应可发生在同一物质之间,如在Cl2+H2O![]() HCl+HClO反应中,Cl2既是氧化剂,又是还原剂,C错误;
HCl+HClO反应中,Cl2既是氧化剂,又是还原剂,C错误;
D.氧化还原反应发生的本质是电子转移,D错误;
故合理选项是A。

【题目】“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。
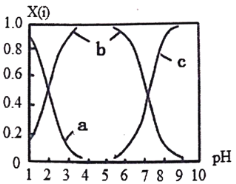
①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
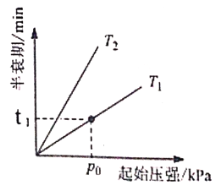
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)