题目内容
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(aq) H+(aq) + In-(aq)
H+(aq) + In-(aq)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液:
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液
⑤NaHCO3溶液 ⑥氨水,
其中能使指示剂显红色的是
HIn(aq)
 H+(aq) + In-(aq)
H+(aq) + In-(aq)红色 黄色
浓度为0.02 mol·L-1的下列各溶液:
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液
⑤NaHCO3溶液 ⑥氨水,
其中能使指示剂显红色的是
| A.①④ | B.②⑤⑥ | C.①④⑤ | D.②③⑥ |
A
此题考查电离平衡:若使指示剂显红色,则HIn分子的成分应增多,In-应减少,故应使该弱电解质的电离平衡向左移动,主要应考虑通过增大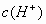 来实现,在所给出的各物质中,能使
来实现,在所给出的各物质中,能使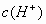 增大的只有盐酸和
增大的只有盐酸和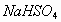 。
。
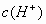 来实现,在所给出的各物质中,能使
来实现,在所给出的各物质中,能使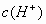 增大的只有盐酸和
增大的只有盐酸和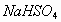 。
。
练习册系列答案
相关题目
 2Z(g)(正反应为放热反应),为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
2Z(g)(正反应为放热反应),为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
 2C0(g) △H>O,K1 ①
2C0(g) △H>O,K1 ①

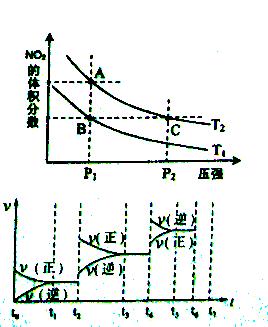
 。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( ) H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是 ( )
H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是 ( )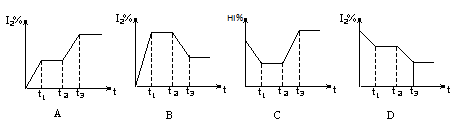
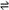 NH3 (g) + HI(g) 2HI(g)
NH3 (g) + HI(g) 2HI(g)