题目内容
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是___________(用编号填写)
a.CH3COONab.Na2CO3 c.NaClOd.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_________(填字母)
A.c(H+) B.![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=________(填准确数值).
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+______________
【答案】a<d<c<b BD ClO﹣+H2O+CO2=HCO3﹣+HClO 9.9×10﹣7molL﹣1 ![]() c(HCO3﹣)+c(H+)
c(HCO3﹣)+c(H+)
【解析】
(1)弱酸的电离平衡常数越大,其酸性越强,其酸根的水解程度越弱;(2)0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,醋酸分子物质的量减小,浓度减小,酸性减弱,水的离子积常数不变,醋酸的电离平衡常数不变;
(1)据电离平衡常数可知,酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO>HCO3-,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,所以pH由小到大排列顺序是a<d<c<b,故答案为:a<d<c<b;(2)0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,浓度减小,酸性减弱,A、氢离子浓度减小,故A错误;
B、加水稀释过程中,氢离子物质的量增大,醋酸分子物质的量减小,所以![]() 增大,故B正确;C、水的离子积常数不变,故C错误;D、醋酸溶液加水稀释时酸性减弱,氢离子浓度减小氢氧根离子浓度增大,所以
增大,故B正确;C、水的离子积常数不变,故C错误;D、醋酸溶液加水稀释时酸性减弱,氢离子浓度减小氢氧根离子浓度增大,所以![]() 增大,故D正确;E、醋酸的电离平衡常数不变,故E错误;故答案为:BD;
增大,故D正确;E、醋酸的电离平衡常数不变,故E错误;故答案为:BD;
(3)次氯酸的酸性强于碳酸氢根离子离子,反应生成碳酸氢根离子,反应的离子方程式为: ClO﹣+H2O+CO2=HCO3﹣+HClO ,因此,本题正确答案是: ClO﹣+H2O+CO2=HCO3﹣+HClO ;
(4) CH3COOH与CH3COONa的混合溶液中,存在电荷守恒: c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(CH3COO-)- c(Na+)= c(H+)- c(OH-)=10-6 mol![]() L﹣1 -10-8 mol
L﹣1 -10-8 mol![]() L﹣1 =9.9×10﹣7mol
L﹣1 =9.9×10﹣7mol![]() L﹣1 ,因此答案: 9.9×10﹣7mol
L﹣1 ,因此答案: 9.9×10﹣7mol![]() L﹣1 ;
L﹣1 ;
(5)溶液显中性则c(H+)=c(OH-)=10-7mol/L,c(CH3COO-)=c(Na+)=b/2mol/L,剩余c(CH3COOH)=(a-b)/2mol/L,Ka=c(H+)![]() c(CH3COO-)/ c(CH3COOH)=
c(CH3COO-)/ c(CH3COOH)=![]() 。
。
7)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中, 1.12L CO2的物质的量为: 1.12L/22.4L![]() mol-1=0.05mol,氢氧化钠的物质的量为:1mol
mol-1=0.05mol,氢氧化钠的物质的量为:1mol![]() -1
-1![]() 0.1L=0.1mol,二者恰好完全反应生成碳酸钠,质子守恒得: c(OH﹣)=2c(H2CO3)+ c(HCO3-)+ c(H+);电荷守恒: c(H+)+c(Na+)=2c(H2CO3)+ c(HCO3-)+ c(OH-),因此,本题正确答案是:①c(HCO3﹣)+c(H+);
0.1L=0.1mol,二者恰好完全反应生成碳酸钠,质子守恒得: c(OH﹣)=2c(H2CO3)+ c(HCO3-)+ c(H+);电荷守恒: c(H+)+c(Na+)=2c(H2CO3)+ c(HCO3-)+ c(OH-),因此,本题正确答案是:①c(HCO3﹣)+c(H+);

【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。
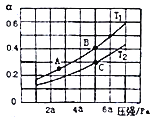
a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
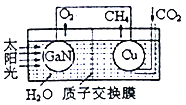
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
【题目】实验室用浓盐酸、二氧化锰共热制氯气,并用制得的氯气和氢氧化钙制取少量漂粉精。现已知反应:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O是放热反应。温度稍高会发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
现有3个同学分别设计的3套实验装置如图:

(1)C装置中发生反应的化学方程式为:___,E装置中发生反应的化学方程式为:___。
(2)请从以下几个方面对甲乙丙3套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表中空格中。___
a.不容易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.污染环境 f.可防止污染环境
优点 | 缺点 | |
甲装置 | ||
乙装置 | ||
丙装置 |
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分的连接顺序是___(按气流流动的方向)。该组合中还缺少的装置是___(用文字说明),需要该装置的原因是___。
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯酸钙的物质的量最多不超过___mol。