题目内容
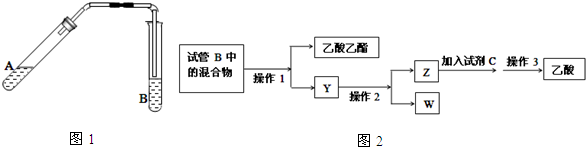
13. A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列说法正确的是( )
A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列说法正确的是( )| A. | 反应①和②互为可逆反应 | B. | X元素可能为铝 | ||
| C. | X元素可能是金属,也可能是非金属 | D. | 反应①和②一定为氧化还原反应 |
分析 由转化关系图可以看出,A这种单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,那么可以看出反应1应该是A物质的歧化反应,反应2应该是关于一种元素的归中反应,则可以知道B和C中应该分别含有A的负价态物质以及正价态物质,则A可能为Cl2或S,应为非金属元素.
解答 解:A.可逆反应的定义是指在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应,叫做可逆反应,上述①②两个反应的反应条件不相同,不是可逆反应,故A错误;
B.A单质在碱性条件下发生反应生成B和C两种化合物,发生了氧化还原反应,化合价既升高又降低,存在负化合价,应为非金属元素,金属元素不存在负价,所以X元素不可能为铝,故B错误;
C.A单质在碱性条件下发生反应生成B和C两种化合物,发生了氧化还原反应,化合价既升高又降低,存在负化合价,应为非金属元素,金属元素不存在负价,故C错误;
D.单质A生成化合物,元素的化合价发生变化,化合物生成A单质,化合价了发生变化,所以反应①和反应②一定属于氧化还原反应,故D正确,
故选D.
点评 本题考查了元素化合物的性质推断,主要考查非金属元素的歧化反应和归中反应的特征应用,关键是理解金属无负价,题目难度中等.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
3. 已知下表所示数据:
已知下表所示数据:
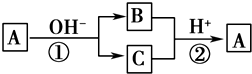
某学生实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管 5~10 min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30 mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL 乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀.
(2)导管不能插入到Na2CO3溶液中的原因是防止倒吸回流现象的发生.
(3)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
(5)充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯.分离出乙酸乙酯层后,可以用用B洗涤.
A.乙醇 B.饱和食盐水
C.碳酸钠溶液 D.NaOH溶液.
 已知下表所示数据:
已知下表所示数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管 5~10 min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30 mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL 乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀.
(2)导管不能插入到Na2CO3溶液中的原因是防止倒吸回流现象的发生.
(3)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
(5)充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯.分离出乙酸乙酯层后,可以用用B洗涤.
A.乙醇 B.饱和食盐水
C.碳酸钠溶液 D.NaOH溶液.
4.下列化学反应中,生成物的总能量高于反应物的总能量的是( )
| A. | Zn与盐酸反应 | B. | CaO与H2O反应 | C. | NaOH与盐酸反应 | D. | C和H2O(g)反应 |
1.下列关于乙烯和聚乙烯的叙述中正确的是( )
| A. | 二者都能使溴的四氯化碳溶液褪色 | B. | 二者互为同系物 | ||
| C. | 二者实验式相同 | D. | 聚乙烯是乙烯的缩聚产物 |
8.用CH3CO18OH和CH3H2OH发生酯化反应,对于18O的说法正确的是( )
| A. | 18O存在于乙酸、乙酸乙酯和水中 | B. | 18O只存在于乙醇中 | ||
| C. | 18O只存在于乙酸和水中 | D. | 18O存在于水中 |
18.下列实验方案能达到预期目的是( )
①用蒸馏的方法将海水淡化
②工业上可用金属铝与V2O5在常温下冶炼矾,铝作还原剂
③向溶液中滴入盐酸酸化的氯化钡溶液检验溶液中是否含有SO42-
④向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,除去Ca(OH)2.
①用蒸馏的方法将海水淡化
②工业上可用金属铝与V2O5在常温下冶炼矾,铝作还原剂
③向溶液中滴入盐酸酸化的氯化钡溶液检验溶液中是否含有SO42-
④向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,除去Ca(OH)2.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
5.下列物质的转化在指定条件下能实现的是( )
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$Na2CO3 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO |
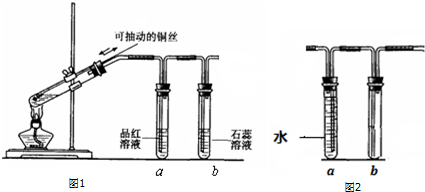 几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设
几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设