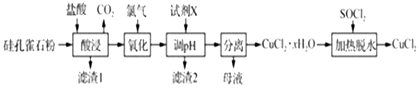
题目内容
【题目】雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应: 
①N2(g)+O2(g)2NO(g)△H1=a kJmol﹣1
②2NO(g)+O2(g)2NO2(g)△H2=b kJmol﹣1
③CO(g)+ ![]() O2(g)CO2(g)△H3=c kJmol﹣1
O2(g)CO2(g)△H3=c kJmol﹣1
④2CO(g)+2NO(g)N2(g)+2CO2(g)△H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4=kJmol﹣1 .
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp=(用表达式表示).
(3)下列情况能说明反应②已达平衡状态的是(填编号).
A.单位时间内生成1mol NO2的同时消耗了lmol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,NO的体积分数保持不变
(4)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线.试分析实际化工生产中不采用高压的原因 .
(5)探究反应④中平衡时CO2的体积分数与反应物中 ![]() 的比值、温度的关系,得到如图2所示的曲线.
的比值、温度的关系,得到如图2所示的曲线.
①在X、Y、Z三点中,CO的转化率从大到小的顺序是 .
②若保持其他条件不变,请在图2中,画出温度为T2(T2<T1)时的变化趋势曲线.
【答案】
(1)2c﹣a
(2)![]()
(3)CD
(4)常压下NO的转化率已经较高,并且高压要增加成本
(5)Z>Y>X
【解析】解:(1)根据盖斯定律,反应②×2﹣③即得,确定反应④2CO(g)+2NO(g)N2(g)+2CO2(g)△H4=(2c﹣a)KJ/mol,所以答案是:2c﹣a;(2)根据反应①的方程式得出Kp= ![]() ,
,
所以答案是: ![]() ;(3)A.单位时间内生成1mol NO2的同时消耗了lmol NO,都是正反应,故不能说明达到平衡状态,故A错误;
;(3)A.单位时间内生成1mol NO2的同时消耗了lmol NO,都是正反应,故不能说明达到平衡状态,故A错误;
B.密度= ![]() ,总质量一定,体积一定,故密度一定,故混合气体的密质不再发生改变不能说明达到平衡状态,故B错误;
,总质量一定,体积一定,故密度一定,故混合气体的密质不再发生改变不能说明达到平衡状态,故B错误;
C.因为平衡常数仅与温度有关,当平衡常数不再变化,即反应的温度不变,又在绝热恒容的容器中,所以反应的平衡常数不再变化能说明达到平衡状态,故C正确;
D.在恒温恒压的容器中,NO的体积分数保持不变,则反应达平衡,能说明达到平衡状态,故D正确;
故选CD,
所以答案是:CD;(4)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,
所以答案是:常压下NO的转化率已经较高,并且高压要增加成本;(5)①温度一定,随反应物NO、CO的起始物质的量比增大,X﹣Y反应正向进行,一氧化碳的转化率X<Y,Y﹣Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X,
所以答案是:Z>Y>X;
②根据图象1分析,温度越低NO的平衡转化率越大,说明该反应为放热反应,所以温度越低,平衡时二氧化碳的体积分数也越大,又T2<T1 , 所以温度为T2时的变化趋势曲线为: 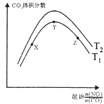 ,
,
所以答案是:  ;
;
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡状态的判断的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能正确解答此题.