题目内容
15. 用以下几种常见有机物填写下列空白:
用以下几种常见有机物填写下列空白:a.CH4 b.C2H4 c.C6H6 d.C2H5OH e.CH3COOH
(1)等质量的CH4、C2H4、C6H6三种烃完全燃烧消耗O2的量由多到少的顺序是a>b>c(用序号表示).
(2)等物质的量混合的甲烷和乙酸蒸气完全燃烧所得二氧化碳和水蒸气的物质的量之比为3:4.
(3)由乙烯和乙醇蒸气组成的混合气体1mol完全燃烧所需氧气在标准状况下的体积为67.2L.
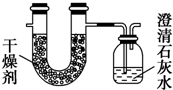
(4)由两种气态烃组成的混合气体完全燃烧后,将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 104.7g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 318.6g |
①假设广口瓶里生成一种正盐,其质量为15g.
②混合气体中C、H两元素的物质的量之比为3:8.
③若混合气体是由CH4和C2H4组成,则二者的体积比为1:1.
分析 (1)由于12gC和4gH完全燃烧时都消耗1molO2,故同质量的烃中含氢量越高,完全燃烧时消耗的氧气越多;
(2)等物质的量混合的甲烷和乙酸蒸气,可以设两者的量各为1mol,然后根据燃烧反应方程式计算;
(3)乙醇的分子式可以写成C2H4•H2O,消耗氧的量相当于乙烯的耗氧,而1mol耗氧量都为3mol;
(4)烃的燃烧产物为CO2和H2O,由题意可知U形管增加的质量为吸收水的质量:104.7g-101.1g=3.6g,n(H2O)=$\frac{3.6g}{18g•mo{l}^{-1}}$=0.2mol,n(H)=0.4mol;广口瓶增加的质量为生成的CO2质量:318.6g-312.0g=6.6g,即0.15mol CO2,对应生成CaCO3 0.15mol,其质量为15g;该混合气体中n(C):n(H)=0.15mol:0.4mol=3:8;由以上数据可得:n(CH4)+2n(C2H4)=0.15mol,4n(CH4)+4n(C2H4)=0.4mol,求得n(CH4)=n(C2H4)=0.05mol,则二者体积比为1:1.
解答 解析(1)由于12gC和4gH完全燃烧时都消耗1molO2,故同质量的烃中含氢量越高,完全燃烧时消耗的氧气越多,C2H4转化为:CH2,C6H6转化为:CH,所以氢的质量分数最大的是甲烷,最小的是苯,完全燃烧消耗O2的量由多到少的顺序a>b>c,故答案为:a>b>c;
(2)假设甲烷和乙酸各为1mol,则它们完全燃烧时共生成CO2 3mol、水蒸气 4mol,则n(CO2):n(H2O)=3:4,故答案为:3:4;
(3)由于反应:C2H4+3O2→2CO2+2H2O、C2H5OH+3O2→2CO2+3H2O,由此可知1mol混合气体完全燃烧消耗氧气一定为3mol,所以体积为:3mol×22.4L/mol=67.2L,故答案为:67.2;
(4)①烃的燃烧产物为CO2和H2O,由题意可知U形管增加的质量为吸收水的质量:104.7g-101.1g=3.6g,n(H2O)=$\frac{3.6g}{18g•mo{l}^{-1}}$=0.2mol,n(H)=0.4mol;广口瓶增加的质量为生成的CO2质量:318.6g-312.0g=6.6g,即0.15mol CO2,对应生成CaCO3 0.15mol,其质量为15g,故答案为:15g;
②该混合气体中n(C):n(H)=0.15mol:0.4mol=3:8,故答案为:3:8;
由以上数据可得:n(CH4)+2n(C2H4)=0.15mol,4n(CH4)+4n(C2H4)=0.4mol,求得n(CH4)=n(C2H4)=0.05mol,则二者体积比为1:1,故答案为:1:1.
点评 本题考查有机物燃烧有关计算,难度不大,注意根据燃烧通式及元素质量分数理解烃耗氧量.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| A. | C60、HD均属于单质 | B. | 漂白粉、明矾均属于混合物 | ||
| C. | 氯化铵、硫酸均属于离子化合物 | D. | SO2、NxOy均属于酸性氧化物 |
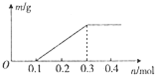
| A. | 氧化性由强到弱的顺序:X3+>Cu2+>H+ | |
| B. | 金属X可能为Al | |
| C. | 据图判断,金属X能与稀硫酸反应产生H2 | |
| D. | 通过电子的物质的量大于0.3mol时,发生反应的化学方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
| A. | C4H10 | B. | C3H6O | C. | CH4O | D. | C2H4Cl2 |
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CCl4 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
| A. | M+N═R+Q | B. | M+2N═2R+Q | C. | 2M+N═R+4Q | D. | 2M+N═R+2Q |
| A. | Fe3+、Cl-、Na+ | B. | Ba2+、Mg2+、CO32- | C. | Na+、K+、CO32- | D. | NO3-、Al3+、OH- |
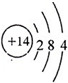
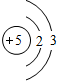

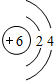 .
.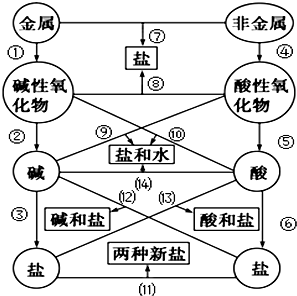 图中的“金属”为Na,“非金属”为S.仔细阅读两种元素在图示中经历的反应变化,回答下列问题.
图中的“金属”为Na,“非金属”为S.仔细阅读两种元素在图示中经历的反应变化,回答下列问题.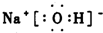 .
.