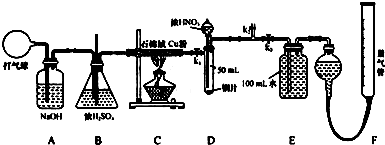
题目内容
9.在实验室中拟用氧化铜、稀硫酸和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案:甲:①把CuO溶于适量稀硫酸中;②在①的溶液中加入适量Zn,充分反应后过滤、烘干,即得纯净的Cu.
乙:①锌与稀H2SO4反应制H2;②将H2通入CuO中并加热,充分反应后即得纯净的Cu.
回答下列问题:
(1)若要制得相同质量的纯Cu,所消耗的锌和稀硫酸的量是:
甲小于乙(填“大于”、“小于”或“等于”),原因是乙方案中氢气除了作还原剂外,还需用来排尽装置中的空气和作保护气.
(2)丙同学认为上述两种方案所制得的Cu都难以保证Cu的纯度,应对上述两种方案加以完善.你是(填“是”或“否”)赞同丙同学的看法.理由①(对甲同学实验而言)甲方案制得的铜中可能混有锌,且过滤后未洗涤,②(对乙同学实验而言)乙方案制得的铜中可能混有氧化铜.
(3)请你分别对甲、乙两同学的实验加以完善:
①将甲过滤所得的固体加入过量的稀硫酸,不断搅拌,至不再放出气体为止,过滤并洗涤、烘干;②将乙所得的固体加入过量的稀硫酸,不断搅拌,充分反应后过滤并洗涤、烘干.
分析 (1)甲的实验方案相关方程式为:Cu+H2SO4=CuSO4+H2↑,Zn+CuSO4=ZnSO4+Cu,乙的实验方案相关方程式为:Zn+H2SO4=ZnSO4+H2↑,H2+CuO=Cu+H2O,从反应来看,两种方案所用H2SO4和Zn的量相同,但由于乙的实验方案中氢气还原氧化铜这一步,要先通氢气,反应结束后还要通一会氢气,故甲方案所用锌的量比乙方案少;
(2)甲通学把CuO溶于适量稀硫酸中反应生成硫酸铜;在硫酸铜的溶液中加入适量Zn,锌必然过量,制得的铜中混有锌,且过滤后未洗涤;
乙中氧化铜不一定能被氢气完全还原,反应不一定成分,制得的铜中可能混有氧化铜;
(3)依据(2)中分析,甲方案中可能含有锌杂质,可以用过量的稀硫酸除去;
乙方案中可能含有杂质氧化铜,氧化铜溶于稀硫酸,所以可以用稀硫酸除去,据此解答.
解答 解:(1)甲的实验方案相关方程式为:Cu+H2SO4=CuSO4+H2↑,Zn+CuSO4=ZnSO4+Cu,乙的实验方案相关方程式为:Zn+H2SO4=ZnSO4+H2↑,H2+CuO=Cu+H2O,从反应来看,两种方案所用H2SO4和Zn的量相同,但由于乙的实验方案中氢气还原氧化铜这一步,要先通氢气,反应结束后还要通一会氢气,故甲方案所用锌的量比乙方案少;
故答案为:小于,乙方案中氢气除了作还原剂外,还需用来排尽装置中的空气和作保护气;
(2)甲通学把CuO溶于适量稀硫酸中反应生成硫酸铜;在硫酸铜的溶液中加入适量Zn,锌必然过量,制得的铜中混有锌,且过滤后未洗涤;乙中氧化铜不一定能被氢气完全还原,反应不一定成分,制得的铜中可能混有氧化铜;所以丙同学观点正确,
故答案为:是;甲方案制得的铜中可能混有锌,且过滤后未洗涤;乙方案制得的铜中可能混有氧化铜;
(3)甲方案中锌过量,可用稀硫酸除去;乙方案中氧化铜过量,也可用稀硫酸除去,具体操作为将甲过滤所得的固体加入过量的稀硫酸,不断搅拌,至不再放出气体为止,过滤并洗涤、烘干;
将乙所得的固体加入过量的稀硫酸,不断搅拌,充分反应后过滤并洗涤、烘干;
故答案为:将甲过滤所得的固体加入过量的稀硫酸,不断搅拌,至不再放出气体为止,过滤并洗涤、烘干;将乙所得的固体加入过量的稀硫酸,不断搅拌,充分反应后过滤并洗涤、烘干.
点评 本题考查了物质制备方案的设计,明确物质的性质和发生的反应是解题关键,注意设计方案的合理性和严密性,题目难度中等.

| A. | 16g H2 | B. | 16g S | C. | 24g Mg | D. | 24g C |
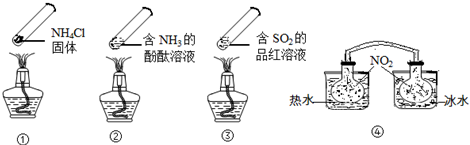
| A. | ④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 | |
| B. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| C. | 加热时,②、③溶液均变红,冷却后又都变为无色 | |
| D. | 四个“封管实验”中所发生的化学反应都是可逆反应 |
| A. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,乙酸乙酯水解、苯与硝酸作用生成硝基苯的反应都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物(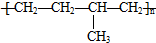 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |