题目内容
4.(1)图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.(2)已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-572kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2598kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=+227kJ•mol-1.
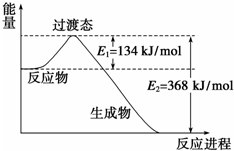
分析 (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;然后根据盖斯定律来解答;
(2)将所给的热化学方程式变形后,根据盖斯定律相加、减后得目标反应,反应热做相应的变化即可.
解答 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1 .
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1
(2)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393kJ/mol
②2H2(g)+O2(g)=2H2O (l)△H2=-572kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O (l)△H3=-2598kJ/mol
根据盖斯定律,①×4+②-③得到反应的热化学方程式为:4C(s,石墨)+2H2(g)=2C2H2(g) △H=+454kJ•mol-1;
热化学方程式为:2C(s,石墨)+H2(g)=C2H2(g) △H=+227kJ•mol-1,
故答案为:+227kJ•mol-1
点评 本题考查了热化学方程式书写方法和盖斯定律的计算应用,焓变可以用反应物总键能-生成物总键能计算,题目难度中等.

练习册系列答案
相关题目
14.氯碱工业的原料为食盐和水,所以氯碱工厂最好是选择靠近生产食盐的基地,以降低食盐的运输成本.下列关于电解NaCl水溶液的说法不正确的是( )
| A. | 电解产物为Cl2和Na | |
| B. | 电解过程中能产生黄绿色气体 | |
| C. | 电解一段时间后,将全部电解液转移到烧杯中,然后滴加酚酞溶液,溶液呈红色 | |
| D. | 用排水集气法可以收集到较纯净的氢气 |
12.下列有关离子(或物质)的检验及结论正确的是( )
| A. | 向黄色溶液中加入淀粉,溶液变蓝色,则溶液中含有I2 | |
| B. | 向无色溶液中加入BaCl2溶液有白色沉淀出现,则溶液中含有SO42- | |
| C. | 向无色溶液中加入稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸变蓝,则溶液中含有NH4+ | |
| D. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中含有Na+不含K+ |
19.普伐他汀是一种调节血脂的药物,其结构如图,下列关于普伐他汀的性质描述正确的是( )


| A. | 不能通过自身反应形成高分子化合物 | |
| B. | 不能使酸性KMnO4溶液褪色 | |
| C. | 能发生加成、取代、消去、氧化反应 | |
| D. | 1 mol该物质最多可与4 mol NaOH反应 |
9.25℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( )
| A. | 中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积 | |
| B. | 往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全 | |
| C. | 将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-) | |
| D. | 25℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10-11 mol•L-1 |
16.常温下,铝与下列溶液作用产生H2的是( )
| A. | 浓硫酸 | B. | 氢氧化钠溶液 | C. | 浓硝酸 | D. | 稀硝酸 |
13.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
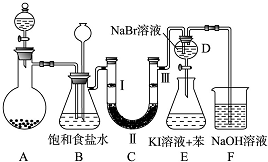
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
装置B中饱和食盐水的作用是除去Cl2中混有的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙色,说明氯单质的氧化比溴单质强.
打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象液体分为两层,上层液体显紫红色.

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
装置B中饱和食盐水的作用是除去Cl2中混有的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象液体分为两层,上层液体显紫红色.
14.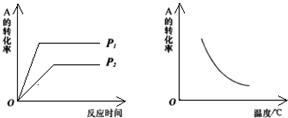 现有可逆反应m A(g)+n B(g)?x C(g);△H=a kJ/mol.该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示.下列判断正确的是( )
现有可逆反应m A(g)+n B(g)?x C(g);△H=a kJ/mol.该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示.下列判断正确的是( )
 现有可逆反应m A(g)+n B(g)?x C(g);△H=a kJ/mol.该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示.下列判断正确的是( )
现有可逆反应m A(g)+n B(g)?x C(g);△H=a kJ/mol.该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示.下列判断正确的是( )| A. | a<0,m+n<x | B. | a<0,m+n>x | C. | a>0,m+n<x | D. | a>0,m+n>x |