题目内容
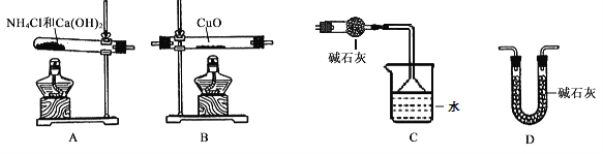
【题目】根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4Cl与Ca(OH)2的量足以产生使CuO完全还原的氨气):
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________。
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的字母表示)A→________________________。
(3)在本实验中,使测定结果Ar(Cu)偏大的是________________________(填序号)。
①CuO未完全反应 ②CuO不干燥
③CuO中混有不反应的杂质 ④NH4Cl与Ca(OH)2混合物不干燥
【答案】2NH3+3CuO![]() 3Cu+3H2O+ N2↑ ADBDC ①③
3Cu+3H2O+ N2↑ ADBDC ①③
【解析】
(1)氨气具有弱还原性,在加热条件下可以被氧化铜氧化,生成氮气、铜和水;
(2)根据题干可知需测定生成水的质量,生成的氨气需先通过碱石灰干燥、再与氧化铜反应,最后用碱石灰吸收生成的水,以测得生成水的质量;
(3)由反应方程式可知氧化铜和水的物质的量相等,列出关系式计算即可;
(4)根据Ar(Cu)=![]() - ﹣16,从是否影响a或b来分析误差。
- ﹣16,从是否影响a或b来分析误差。
(1)氨气具有弱还原性,在加热条件下可以被氧化铜氧化,反应物为氮气、铜和水,反应的化学方程式为2NH3+3CuO![]() 3Cu+3H2O+ N2,
3Cu+3H2O+ N2,
故答案为:2NH3+3CuO![]() 3Cu+3H2O+ N2;
3Cu+3H2O+ N2;
(2)因为需要测定反应后生成物水的质量,所以必需保证通入的氨气是纯净干燥的,由于浓硫酸可以与氨气反应,因此只能通过碱石灰进行干燥,再通入氧化铜进行反应,最后在通入碱石灰吸收反应生成的水,以测得生成水的质量,所以正确的顺序为ADBDC,
故答案为:ADBDC;
(3)根据反应方程式
2NH3+3CuO![]() 3Cu+3H2O+ N2
3Cu+3H2O+ N2
3 3
可知氧化铜和水的物质的量相等,所以有以下关系式:![]() =
=![]() ,
,
解得Ar(Cu)=![]() =
= ![]() - ﹣16,
- ﹣16,
①若CuO未完全起反应,说明b偏小,结果偏大;
②若CuO不干燥,说明a偏小,b偏大,结果偏低;
③若CuO中混有不反应的杂质,说明b偏小,结果偏大;
④若NH4Cl与Ca(OH)2混合物不干燥,但只要氨气干燥彻底,对结果不影响。
所以选项①③正确,
故答案为:①③。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案