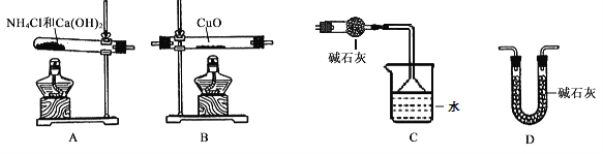
题目内容
【题目】下列属于吸热反应的是( )
A.生石灰与水反应
B.氢氧化镁与盐酸反应
C.氢氧化钡晶体与氯化铵晶体反应
D.铝粉与二氧化锰混合在高温下的铝热反应
【答案】C
【解析】
A. 生石灰与水反应生成氢氧化钙,是放热反应,故A不符合题意;
B. 氢氧化镁与盐酸反应是放热反应,故B不符合题意;
C. 氢氧化钡晶体与氯化铵晶体反应是吸热反应,故C符合题意;
D. 铝粉与二氧化锰混合在高温下的铝热反应是放热反应,故D不符合题意。
综上所述,答案为C。

【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:

已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
请回答:
(1)写出碳酸锶与盐酸反应的离子方程式_______________。
(2)在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜选用的试剂为__________(写一种)。
(3)关于上述流程中各步骤的说法,正确的是_____________。
A.调节pH后加热煮沸的原因是除去H2O2,并避免生成Fe(OH)3胶体
B.步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
C.可以通过加快结晶速率的方法来得到较大颗粒的SrCl2·6H2O 晶体
D.步骤⑥干燥SrCl2·6H2O晶体可以采用减压干燥
(4)为了测定所得SrCl2·6H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO3 2.38g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.200mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,当_______________时达到滴定终点,用去NH4SCN溶液20.0mL,则原SrCl2·6H2O晶体的纯度为_________________________。