题目内容
【题目】从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染.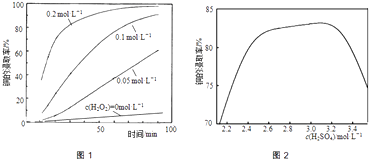
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为 .
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2﹣HCl﹣NaCl混合溶液浸取回收.
①用FeCl3溶液浸取铜时发生反应的离子方程式为;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是 .
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3molL﹣1盐酸、0.5molL﹣1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图1所示.当c(H2O2)=0molL﹣1时,也有少量的铜被浸出,其原因是 .
③用H2O2﹣HCl﹣NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ) Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ) Cu2++Cu2Cu+
(Ⅲ) Cu++nCl﹣CuCln(n﹣1)﹣
(Ⅳ) 2CuCln(n﹣1)﹣+2H++H2O2=2Cu2++2H2O+2nCl﹣
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是(填序号).
a.Na+ b.Cu2+ c.Cl﹣d.OH﹣
(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl﹣H2O2混合溶液浸取.
①Cu2S被HCl﹣H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为 .
②若由H2SO4代替HCl﹣H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图2所示.当H2SO4浓度大于3.1molL﹣1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是 .
【答案】
(1)Cu﹣2e﹣=Cu2+和Sn﹣2e﹣=Sn2+
(2)2Fe3++Cu=2Fe2++Cu2+;c(H+)和c(Fe3+)小,有利于Fe3+水解生成Fe(OH)3沉淀;液面上方空气中O2随搅拌不断进入溶液,溶解的O2将铜氧化而被浸取;bc
(3)Cu2S+5H2O2+2HCl=CuCl2+CuSO4+6H2O;过量的硫酸会生成PbSO4沉淀包裹在铅冰铜颗粒表面,使铜无法与浸出液接触
【解析】解:(1)电解法精炼铜,阳极为活性电极,电极本身参与放电,铜失去电子发生氧化反应,电极反应式:Cu﹣2e﹣=Cu2+;锡失去电子生成锡离子,电极反应式:Sn﹣2e﹣=Sn2+;
所以答案是:Cu﹣2e﹣=Cu2+ 和Sn﹣2e﹣=Sn2+;
2)①三价铁离子能够氧化铜生成铜离子,本身被还原为二价铁离子,离子方程式:2Fe3++Cu=2Fe2++Cu2+;
若加盐酸不足,溶液中氢离子浓度较小,三价铁离子水解生成氢氧化铁,所以若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀;
所以答案是:2Fe3++Cu=2Fe2++Cu2+;
c(H+)和c(Fe3+)小,有利于Fe3+水解生成Fe(OH)3沉淀;
②当c(H2O2)=0molL﹣1时,液面上方空气中O2随搅拌不断进入溶液,溶解的O2将铜氧化而被浸取,所以也有少量的铜被浸出;
所以答案是:液面上方空气中O2随搅拌不断进入溶液,溶解的O2将铜氧化而被浸取;
③a.依据给出的方程式可知,上述反应与钠离子都无关,所以改变钠离子的浓度,不影响Cu从废电路板中浸出,故a不选;
b.由Cu2++Cu2Cu+可知增大铜离子浓度,上述反应的速率加快,故b选;
c.由Cu++nCl﹣CuCln(n﹣1)﹣可知增大Cl﹣浓度,反应Ⅲ加快,故c选;
d.氢氧根离子能够与氢离子、铜离子反应,增大氢氧根离子浓度,能够使氢离子、铜离子浓度减小,反应速率减慢,故d不选;
故选:bc;
3)①Cu2S在盐酸的酸性环境下被过氧化氢生成硫酸铜、氯化铜和水,依据得失电子守恒,原子个数守恒反应的方程式为:Cu2S+5H2O2+2HCl=CuCl2+CuSO4+6H2O;
所以答案是:Cu2S+5H2O2+2HCl=CuCl2+CuSO4+6H2O;
②由H2SO4代替HCl﹣H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图2所示.当H2SO4浓度大于3.1molL﹣1时,过量的硫酸会生成PbSO4沉淀包裹在铅冰铜颗粒表面,使铜无法与浸出液接触,使得硫酸浓度越大,铜的浸取率反而越小;
所以答案是:过量的硫酸会生成PbSO4沉淀包裹在铅冰铜颗粒表面,使铜无法与浸出液接触;

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案