题目内容
向20 mL氢氧化钠溶液中逐滴加入0. 2 mol/L醋酸溶液,滴定曲线如下图所示下列说法不正确的是 ( )
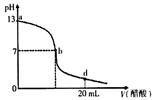

| A.该氢氧化钠溶液的物质的量浓度为0.1 mol/L . |
| B.在b点,c (Na+)=c(CH3COO-) |
| C.在d点,溶液中所有离子浓度由大到小的顺序为 c (CH3COO-)>c (Na+)>c (H+)>c (OH-) |
| D.氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 |
D
由图像得:V(醋酸)=0时,PH=13,即氢氧化钠溶液的PH=13,则C(OH-)="0.1" mol/L,故A正确;
在b点时,PH=7,则[H+]=[OH-],再利用电荷守恒:[Na+]+[H+]=[CH3COO-]+[OH-],故B正确;
在d点时,NaOH+CH3COOH=CH3COONa+H2O反应后,溶液变成为等浓度的CH3COOH、CH3COONa的混合物(前者考虑电离平衡,后者考虑水解平衡):PH<7,即:c (H+)>c (OH-),且同样存在电荷守恒:[Na+]+[H+]=[CH3COO-]+[OH-], 则:[Na+]<[CH3COO-],故C正确;
氢氧化钠溶液与醋酸溶液恰好完全反应时,生成CH3COONa,CH3COONa水解呈碱性,PH>7,故应是位于曲线a、b间的某点,故D错误;
在b点时,PH=7,则[H+]=[OH-],再利用电荷守恒:[Na+]+[H+]=[CH3COO-]+[OH-],故B正确;
在d点时,NaOH+CH3COOH=CH3COONa+H2O反应后,溶液变成为等浓度的CH3COOH、CH3COONa的混合物(前者考虑电离平衡,后者考虑水解平衡):PH<7,即:c (H+)>c (OH-),且同样存在电荷守恒:[Na+]+[H+]=[CH3COO-]+[OH-], 则:[Na+]<[CH3COO-],故C正确;
氢氧化钠溶液与醋酸溶液恰好完全反应时,生成CH3COONa,CH3COONa水解呈碱性,PH>7,故应是位于曲线a、b间的某点,故D错误;

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
 。
。


