题目内容
(14分)从能量的变化和反应的快慢等角度研究反应: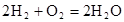 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
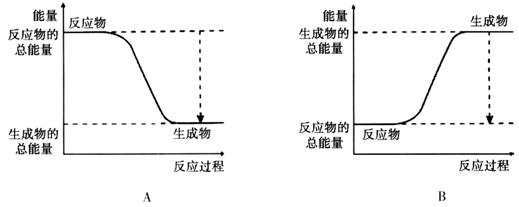
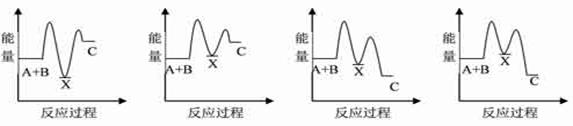
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。已知:化学键的键能:
由此计算2molH2在氧气中燃烧生成气态水放出的热量
(4)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为
(5)氢氧燃料电池的总反应方程式为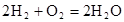 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
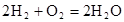 。
。 (1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
| A.使用催化剂 | B.提高氧气的浓度 |
| C.提高反应的温度 | D.降低反应的温度 |

(3)从断键和成键的角度分析上述反应中能量的变化。已知:化学键的键能:
| 化学键 | H—H | O=O | H—O |
键能 | 436 | 496 | 463 |
(4)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为
(5)氢氧燃料电池的总反应方程式为
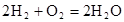 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。(1) ABC (2)A (3)484KJ
(4)2H2 (g)+ O2(g)=2H2O(l) △H=-4QKJ/mol (5)负 氧化 2.24L
(4)2H2 (g)+ O2(g)=2H2O(l) △H=-4QKJ/mol (5)负 氧化 2.24L
试题分析:(1)A. 使用催化剂可以大大加快正反应速率。正确。B. 因为氧气是反应物。提高氧气的浓度,及增大反应物的浓度,可以加快化学反应速率。正确。正确。C. 提高反应的温度。可以加快化学反应速率。正确。D. 降低反应的温度,减慢化学反应速率。错误。(2)由于已知该反应为放热反应。则反应物的能量高于生成物的能量,在发生反应时多余的能量释放出来。图像应该为A。(3)断裂化学键吸收能量,形成化学键释放能量,反应过程中的能量变化就是二者的差值,所以2molH2在氧气中燃烧生成气态水放出的热量是2mol×436kJ/mol+1mol×496 kJ/mol-4mol×463 kJ/mol=484KJ.即氧气中燃烧生成气态水的热反应方程式为2H2 (g)+ O2(g)=2H2O(g)。ΔH=-484KJ/mol. (4)因为1克氢气完全燃烧生成液态水放出QKJ的热量,所以氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+ O2(g)=2H2O(l) △H=-4QKJ/mol。(5)在氢氧燃料电池中通入氢气的电极为负极,负极发生氧化反应,n(e-)=0.2mol。则n(H2)=0.1mol. 在标准状况下消耗H2的体积是V=0.1mol×22.4L/mol=2.24L.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
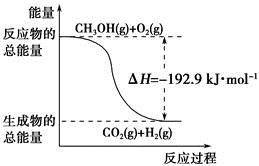
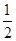 O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1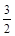 O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol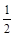 O2(g) = NO3-(aq) ΔH = -73kL/mol
O2(g) = NO3-(aq) ΔH = -73kL/mol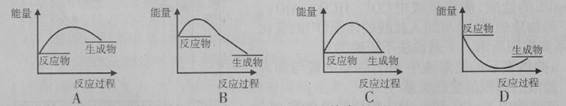
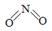 和
和 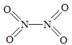 。
。
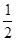 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1