题目内容
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示。下列说法正确的是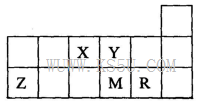
| A.元素X和M的氧化物对应的水化物均为强酸 |
| B.R的单质能与M的氢化物发生置换反应 |
| C.气态氢化物的稳定性:M>Y |
| D.元素Y、Z形成的简单离子半径大小关系为:Z>Y |
B
解析试题分析:有元素在周期表中的位置可知:X:N;Y:O;Z:Al; M:S;R:Cl。N有多种氧化物,NO、NO2为不成盐氧化物,N2O3对应的水化物HNO2是弱酸,S的氧化物SO2对应的水化物H2SO3也为弱酸。错误。B.Cl2+H2S=2HCl+S.正确。C.元素的非金属性越强,其氢化物的稳定性就越强。由于非金属性O>S。所以气态氢化物的稳定性:H2O > H2S。错误。D.对于电子层结构相同的离子来说,元素的核电荷数越多,离子半径就越小。O2-、 Al3+的的核外电子排布均为2 8;但核电荷数Al3+ >O2-,所以离子半径:O2->Al3+。错误。
考点:考查元素周期表、元素周期律的知识。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案下列各选项所述的两个量,前者一定大于后者的是
①3d轨道的能量和4s轨道的能量;②同一电子层中第一个p轨道与第二个p轨道的能量;③2s和3s的轨道半径;④同一原子的基态和激发态;⑤F元素和O元素的电负性;⑥Mg元素和Al元素的第一电离能;⑦H原子和H+离子的半径
| A.①⑤⑥⑦ | B.②③⑤ | C.②④⑦ | D.全对 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列说法正确的是
| W | X | |
| | Y | Z |
B.Z元素最高价氧化物对应水化物的酸性一定强于Y
C.X与Y元素的化合价完全相同
D.Z元素单质在化学反应中只表现氧化性
甲、乙、丙、丁4种物质均为含有两种元素的化合物,其分子均含有18个电子,下列说法正确的是( )
| A.若气体甲的水溶液在常温下的pH<7,则甲一定是HCl |
| B.若气体乙的摩尔质量与O2相同,则乙一定是N2H4 |
| C.若3.0g丙的物质的量为0.1mol,则丙一定是甲烷的同系物 |
| D.若丁为四原子分子,则丁一定能使品红溶液褪色 |
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻,X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y.下列说法 正确的是 ( )
| A.还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
| C.YX2、M2Y都含有极性共价键 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |
已知1~18号元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是。
| A.离子半径 W2+>X+ | B.离子的还原性Y2->Z- |
| C.氢化物的稳定性 H2Y>HZ | D.原子半径 X < W |
短周期元素W、X、Y、和Z的原子序数依次增大,元素W是制造一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是电子层数的2倍。下列说法中错误的是:( )
| A.元素W、X的氯化物中,各原子均满足8电子的稳定结构。 |
| B.元素X与氢形成的原子比为1:1的化合物有很多种 |
| C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| D.元素Z可与元素X形成共价化合物XZ2 |
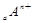 、
、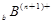 、
、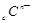 、
、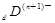 电子层结构相同。关于A、B、C、D四种元素叙述正确的是
电子层结构相同。关于A、B、C、D四种元素叙述正确的是