题目内容
已知1~18号元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是。
| A.离子半径 W2+>X+ | B.离子的还原性Y2->Z- |
| C.氢化物的稳定性 H2Y>HZ | D.原子半径 X < W |
B
解析试题分析:由于这几种元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,所以原子序数W>X>Z>Y。A.对于电子层结构相同的离子来说,核电荷数越大,离子半径越小。离子半径X+>W2+。错误。B.元素的非金属性越强,其简单的离子的还原性就越弱。所以离子的还原性Y2->Z-。正确。C.元素的非金属性越强,其氢化就越稳定。故氢化物的稳定性HZ>H2Y 。错误。D.X、W是同一周期的元素。对于同一周期的元素来说,核电荷数越大,原子半径就越小。所以原子半径W<X 。错误。
考点:考查电子层结构相同的离子的半径、还原性及相应的原子半径、氢化物的稳定性的知识。

四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是
| A.原子半径Z<M |
| B.Y的最高价氧化物对应水化物的酸性比X 的弱 |
| C.X 的最简单气态氢化物的热稳定性比Z的小 |
| D.Z位于元索周期表中第2 周期、第ⅥA族 |
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示。下列说法正确的是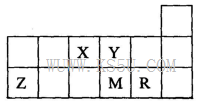
| A.元素X和M的氧化物对应的水化物均为强酸 |
| B.R的单质能与M的氢化物发生置换反应 |
| C.气态氢化物的稳定性:M>Y |
| D.元素Y、Z形成的简单离子半径大小关系为:Z>Y |
短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
| A.元素非金属性:Z> Y > X | B.最高价氧化物水化物酸性:Z > Y |
| C.原子半径:Z < Y < X | D.气态氢化物的稳定性:Z < Y < X |
2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注。235 92U是一种重要的核燃
料,235 92U和 238 92U的关系是
| A.中子数相同 | B.同种原子 | C.同位素 | D.同种核素 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )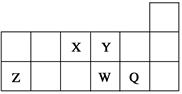
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.元素Y、W的气态氢化物的稳定性,前者比后者差 |
| C.离子Y2-和Z3+的离子半径,后者比前者大 |
| D.元素W的最高价氧化物对应的水化物酸性比Q的强 |
元素周期表中铋元素的数据见图,下列说法正确的是( )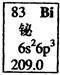
| A.Bi元素的质量数是209 |
| B.Bi元素的相对原子质量是209.0 |
| C.Bi原子6p亚层(能级)有一个未成对电子 |
| D.Bi原子最外层有5个能量相同的电子 |
X、Y、Z、W、M五种元素的原子序数依次增大,且X、Y、Z、W均为短周期中的非金属元素,X元素的原子形成的阴离子核外排布与氦原子相同,Z、W在周期表中处于相邻位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法正确的是( )
| A.五种元素的原子半径从大到小的顺序是:M> W> Z>Y>X |
| B.化合物X2W2、YW2、ZW2都含有极性共价键和非极性共价键 |
| C.工业上通常用电解熔融的MCl3来冶炼金属M |
| D.Z、X两元素能形成原子个数比为1∶3和2∶4的化合物 |
自然界中氧元素有三种同位素16O、17O、18O,氧元素的相对原子质量为15.9994,
由此可知16O的相对原子质量为( )
| A.>16 | B.<16 | C.=16 | D.不能确定 |