题目内容
【题目】(1)基态溴原子的价层电子轨道排布式为________,第四周期中,与溴原子未成对电子数相同的金属元素有 ______种。
(2)铍与铝的元素性质相似。下列有关铍和铝的叙述正确的有_________(填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)OF2分子中,O的杂化类型为______,与下列微粒的中心原子杂化方式相同且空间构型也与OF2相同的是_______(填字母), OF2分子VSEPR模型的名称为__________
A.PCl3 B.SO3 C. NH2- D.NO3-
(4)P元素有白磷、红磷、黑磷三种常见的单质。
①白磷(P4)易溶于CS2,难溶于水,原因是_____________________________________________。
②黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是_______。
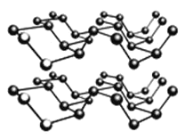
A.黑磷晶体中磷原子杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(5)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。其晶胞与金刚石相似,其中B原子处于晶胞体内,P原子处于晶胞表面。
①磷化硼晶体属于_____晶体(填晶体类型),_____ (填“是”或“否”)含有配位键。
③已知BP的晶胞中最近的B与P原子核间距为a nm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度表达式为________________g·cm-3(用含a、NA的式子表示)。
【答案】![]() 4 BD sp3 C 四面体 P4、CS2是非极性分子,H2O是极性分子,根据相似相溶原理,P4难溶于水 BD 原子 是
4 BD sp3 C 四面体 P4、CS2是非极性分子,H2O是极性分子,根据相似相溶原理,P4难溶于水 BD 原子 是 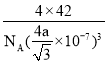 g·cm-3
g·cm-3
【解析】
(1)溴处于第四周期第ⅦA族;第四周期中,与溴原子未成对电子数相同的金属元素原子价电子排布式为:4s1、3d14s2、3d104s1、4s24p1;
(2)A.Be属于s区元素;
B.同主族自上而下电负性增大,同周期主族元素自左而右电负性增大;
C.Al失去的是3p1电子,3p轨道能量比3s能量高;
D.镁离子水解,溶液呈酸性;
(3)OF2分子中O原子孤电子对数(6-1×2)/2=2,价层电子对数=2+4=4;中心原子杂化方式相同且空间构型也与OF2相同的,中心原子有2对孤对电子,价层电子对数为4;
(4)①根据相似相溶原理解答;
②A.P原子形成3个P-P键,有1对共用电子对,杂化轨道数目为4;
B.层与层之间的作用力是分子间作用力;
C.P原子采取sp3杂化,P原子与周围的3个P原子形成三角锥形;
D.黑鳞中层内形成共价键,破坏共价键需要的能量高,而另外两种破坏的是范德华力,需要能量较低;
(5)①磷化硼晶胞与金刚石相似,属于原子晶体;B原子核外3个电子,形成3个B-P键,而P原子形成4个键,B原子有空轨道,P原子提供1对孤电子对给B原子;
②假设B原子处于晶胞内部,BP晶胞结构为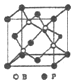 ,均摊法计算晶胞中B、P原子数目,计算晶胞中原子总质量,即为晶胞质量。B周围的4个P原子形成正四面体,B原子处于正四面体的体心,由几何知识可知,顶点P原子与四面体中心B原子之间连线处于晶胞体对角线上且长度等于体对角线长度的1/4,故晶胞棱长=4a nm÷
,均摊法计算晶胞中B、P原子数目,计算晶胞中原子总质量,即为晶胞质量。B周围的4个P原子形成正四面体,B原子处于正四面体的体心,由几何知识可知,顶点P原子与四面体中心B原子之间连线处于晶胞体对角线上且长度等于体对角线长度的1/4,故晶胞棱长=4a nm÷![]() .而晶体密度=晶胞质量÷晶胞体积。
.而晶体密度=晶胞质量÷晶胞体积。
(1)溴处于第四周期第ⅦA族,价电子排布图为:![]() ;第四周期中,与溴原子未成对电子数相同的金属元素原子价电子排布式为:4s1、3d14s2、3d104s1、4s24p1,共有4种;
;第四周期中,与溴原子未成对电子数相同的金属元素原子价电子排布式为:4s1、3d14s2、3d104s1、4s24p1,共有4种;
(2)A.Al属于p区元素,Be属于s区元素,故A错误;
B.同主族自上而下电负性增大,同周期主族元素自左而右电负性增大,Be、Al的电负性均大于Mg的,故B正确;
C.Mg失去是3s轨道电子,而Al失去的是3p1电子,3p轨道能量比3s能量高,故Mg第一电离能高于Al的,故C错误;
D.镁离子水解,溶液呈酸性,即氯化镁水溶液pH均小于7,故D正确,
故选:BD;
(3)OF2分子中O原子孤电子对数(6-1×2)/2=2,价层电子对数=2+2=4,O原子采取sp3杂化;
A、PCl3中P原子孤电子对数=(5-1×3)/2=1,价层电子对数为1+3=4.
B、SO3中S原子孤电子对数=(6-2×3)/2=0,价层电子对数=0+3=3.
C、NH2- 中N原子孤电子对数=(5+1-1×2)/2=2,价层电子对=2+2=4,NO3-中N原子孤电子对数=(5+1-2×3)/2=0,价层电子对数=0+3=3,故中心原子杂化方式相同且空间构型也与OF2相同的是NH2-;
故选C;
OF2分子中氧原子价层电子对数为4,故其VSEPR模型的名称为四面体,
(4)①P4、CS2是非极性分子,H2O是极性分子,根据相似相溶原理,P4难溶于水、易溶于CS2,
故答案为:P4、CS2是非极性分子,H2O是极性分子,根据相似相溶原理,P4难溶于水、易溶于CS2;
②A.P原子形成3个P-P键,有1对共用电子对,杂化轨道数目为4,P原子采取sp3杂化,故A错误;
B.层与层之间的作用力是分子间作用力,故B正确;
C.P原子采取sp3杂化,P原子与周围的3个P原子形成三角锥形,每一层中P原子不可能都在同一平面上,故C错误;
D.黑鳞中层内形成共价键,破坏共价键需要的能量高,而另外两种破坏的是范德华力,需要能量较低,故黑鳞的熔沸点最高,故D正确;
故选:BD;
(5)①磷化硼晶胞与金刚石相似,属于原子晶体;
B原子核外3个电子,形成3个B-P键,而P原子形成4个键,B原子有空轨道,P原子提供1对孤电子对给B原子形成1个配位;
②假设B原子处于晶胞内部,BP晶胞结构为 ,晶胞中P原子数目=8×1/8+6×1/2=4、B原子数目=4,晶胞质量=4×(31+11)/NAg.B周围的4个P原子形成正四面体,B原子处于正四面体的体心,由几何知识可知,顶点P原子与四面体中心B原子之间连线处于晶胞体对角线上且长度等于体对角线长度的1/4,故晶胞棱长=4a nm÷
,晶胞中P原子数目=8×1/8+6×1/2=4、B原子数目=4,晶胞质量=4×(31+11)/NAg.B周围的4个P原子形成正四面体,B原子处于正四面体的体心,由几何知识可知,顶点P原子与四面体中心B原子之间连线处于晶胞体对角线上且长度等于体对角线长度的1/4,故晶胞棱长=4a nm÷![]() =4a/
=4a/![]() nm,故晶体密度=
nm,故晶体密度=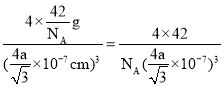 g·cm-3。
g·cm-3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案