题目内容
【题目】按要求回答下列问题:
(1)在标准状况下,V L H2 中含有 N 个氢分子,则阿伏加德罗常数为_____mol-1
(2)8.5 g氢氧根离子含有的电子数目为________。
(3)已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量的D;现将16 g A与70 g B混合,充分反应后,生成2 mol D和一定量的C,则D的相对分子质量为_________。
(4)标准状况下,8.96L的CH4和CO的混合气体,该混合气体对氢气的相对密度是9.5,则混合气体平均摩尔质量为____________,混合气体中CH4与CO的体积比为____。
(5)若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(用带字母的表达式回答)
【答案】![]() 3.01×1022 18 19g/mol 3:1
3.01×1022 18 19g/mol 3:1 ![]()
【解析】
(1)根据NA=![]() 进行计算;
进行计算;
(2)根据n=![]() 、N=nNA进行计算;
、N=nNA进行计算;
(3)根据质量守恒结合M=![]() 进行计算;
进行计算;
(4)根据V=nVm进行计算;
(5)根据c=![]() 进行计算。
进行计算。
(1)氢气物质的量为![]() =
=![]() mol,则N=
mol,则N=![]() mol×NA mol-1,故NA=
mol×NA mol-1,故NA=![]() mol-1;
mol-1;
(2)8.5 g氢氧根离子的物质的量为![]() ,氢氧根离子含有10个电子,故0.5mol氢氧根离子所含有的电子数目为0.5mol×10×6.02×1023=3.01×1022;
,氢氧根离子含有10个电子,故0.5mol氢氧根离子所含有的电子数目为0.5mol×10×6.02×1023=3.01×1022;
(3)根据质量守恒,生成D的质量为(8+32-22)g=18g,16gA完全参加反应需要B的质量为32×16÷8g=64g,B过量,因此产生D的质量为16×![]() g=36g,D的摩尔质量为
g=36g,D的摩尔质量为![]() g/mol=18g/mol;
g/mol=18g/mol;
(4)在标准状况下,8.96L的CH4和CO的混合气体的物质的量为![]() =0.4mol,二者对氢气相对密度是9.5,可知混合气体的平均相对分子质量为2×9.5=19,即混合气体平均摩尔质量为19g/mol;
=0.4mol,二者对氢气相对密度是9.5,可知混合气体的平均相对分子质量为2×9.5=19,即混合气体平均摩尔质量为19g/mol;
设混合气体中CH4的物质的量为nmol,则CO的物质的量为(0.4-n)mol,可知:16n+28(0.4-n)=19g/mol×0.4mol,解得:n=0.3mol,可知CH4的体积为0.3mol×22.4L/mol=6.72L;CO的体积为(0.4-n)mol×22.4L/mol=2.24L;混合气体中CH4与CO的体积比为6.72L:22.4L=3:1;
(5)HCl的物质的量为![]() =
=![]() mol,HCl的质量为
mol,HCl的质量为![]() mol×36.5g/mol=
mol×36.5g/mol=![]() g,1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为(
g,1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为(![]() +1000)g,溶液的体积为
+1000)g,溶液的体积为 =
=![]() L,故所得溶液的物质的量浓度为
L,故所得溶液的物质的量浓度为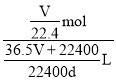 =
=![]() mol/L。
mol/L。