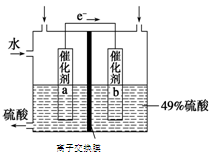
题目内容
(本题16分)
(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 物质 物质T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2 B.T1<T2 C.T1=T2 D.无法比较
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g); ΔH= - 1266.8 kJ/mol
N2(g) + O2(g) =" 2NO(g)" ; ΔH =" +" 180.5kJ/mol,
则氨催化氧化的热化学方程式为________________________________________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。

当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为___________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将___________(填“正向”、“逆向”或“不”)移动。
(4)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的两种Cu2O分别进行催化分解水的实验:
 ΔH >0
ΔH >0水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
(5)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极和乙醛-Na2SO4溶液为电解质溶液,乙醛分别在阴、阳极转化为乙醇和乙酸。
总反应为:2CH3CHO+H2O
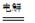 CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O; 。
(1)①2CO + 2 NO = N2 + 2CO2 (2分)
②A (2分)
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-905.8kJ/mol(2分)
(3)10(2分) 逆向(2分)
(4)3.5×10-5 mol·L-1 min-1(2分) <(2分)
(5)CH3CHO -2e-+H2O═CH3COOH+2H+ (2分)
解析试题分析:
(1)NO和CO在一定条件下转化为“两种无毒气体E和F”,根据元素的性质和氧化还原反应的方法可知无毒的气体当为N2和CO2
②因为“已知该反应△H<0”,所以升高温度,平衡将向逆反应方向移动,K值减小;所以根据表中的数据可算两个温度下的平衡常数就可以得出,平衡常数小的T值大。
(2)氨催化氧化后生成一氧化氮和水,先写出化学方程式,标明状态,根据盖斯定律就可以得到。
(3)计算该条件下平衡浓度,再根据方程式写出平衡常数的表达式,求算可得;当加再加入0.36mol的N2后,体积会增大,利用同T、P下,体积比等于物质的量之比,(1.0mol+0.4mol+0.4mol)/2.0L=(1.0mol+0.4mol+0.4mol+0.36mol)/V,求出V后,再求出此时各气体的浓度,运用Qc=c2(NH3)/c(N2)﹒c3(H2)与K值大小比较,判断反应进行的方向。
(4)审清题意“实验①的前20 min,ν(O2)”,ν(H2O)=(0.050-0.0486)mol·L-1/20min
再根据反应速率之比等于化学计量数之比,求得ν(O2);比较实验①和实验②达到平衡所需要的时间,便可判断催化剂的催化效果。
(5)阳极上的另一个反应,当从题干中去找答案,先根据总式写出
CH3CHO -2e- → CH3COOH ,再根据电解质溶液为Na2SO4,可知在式子的左边当加水,右边当是H+,再根据电荷守恒配平即可。
考点:有关氧化还原方程式的书写;盖斯定律的运用;影响化学平衡移动的因素;阿伏加德罗定律的运用;化学反应速率的计算;化学平衡移动的方向判断;电化学中电极反应式的书写。

在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是 ( )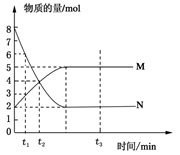
| A.t2时M与N的物质的量浓度之比为1:1 |
| B.t2与t3时刻的混合气体的平均相对分子质量相等 |
| C.反应物与生成物平衡时的物质的量浓度之比是2:5 |
D.0~t2内用M表示的平均反应速率是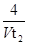 mol/(L?min) mol/(L?min) |
(8分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO (g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)下列各项能作为判断反应Ⅰ在2 L的密闭容器中达到化学平衡状态的依据的是_______(填序号字母)。
A.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.2v(H2)(正)= v(CO)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: ,该反应是 反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与 有关。
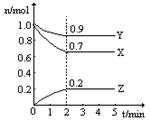
Ⅱ.某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如右图所示,图中数据分析:
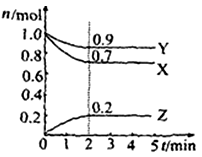
(1)该反应的化学方程式为: 。
(2)反应开始至2min,用Z表示的平均反应速率为: 。
(3)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g) = 2Z(g),当改变下列条件时,反应速率会减小
A.降低温度 B.加入催化剂 C.增大容器体积
 2SO3 测得平衡时混合物总物质的量为5mol,求:
2SO3 测得平衡时混合物总物质的量为5mol,求: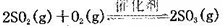 (正反应放热)。测得n(O2)随时间的变化如下表
(正反应放热)。测得n(O2)随时间的变化如下表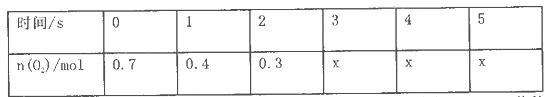
 H2+I2
H2+I2