题目内容
(16分)Na2S2O8溶液可降解有机污染物4-CP,原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-)。通过测定4-CP降解率可判断Na2S2O8溶液产生(SO4-·)的量。某研究小组探究溶液酸碱性、Fe2+的浓度对产生(SO4-·)的影响。


(1)溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强, (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
(2)Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。
已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+,此外还可能会发生:SO4-· + Fe2+=SO42- + Fe3+
① 实验开始前,检验FeSO4溶液是否被氧化的试剂是 (化学式)。如被氧化可以观察到的现象是 。
②当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为 %,4-CP降解的平均反应速率的计算表达式为 。
③当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是 。


(1)溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强, (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
(2)Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。
已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+,此外还可能会发生:SO4-· + Fe2+=SO42- + Fe3+
① 实验开始前,检验FeSO4溶液是否被氧化的试剂是 (化学式)。如被氧化可以观察到的现象是 。
②当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为 %,4-CP降解的平均反应速率的计算表达式为 。
③当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是 。
(1) 有利于 (3分)
(2)① KSCN (2分); 溶液呈红色; (2分)
②52.4 (3分)
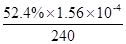
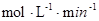 (3分)
(3分)
③Fe2+浓度过高时,Fe2+会与SO4—,发生反应,消耗部分SO4—,导致4-CP降解率下降。(3分)
(2)① KSCN (2分); 溶液呈红色; (2分)
②52.4 (3分)
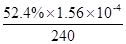
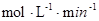 (3分)
(3分) ③Fe2+浓度过高时,Fe2+会与SO4—,发生反应,消耗部分SO4—,导致4-CP降解率下降。(3分)
试题分析:⑴据图a分析,PH越小(酸性越强),4-CP的降解率增大,则Na2S2O8溶液产生SO4-的量增多,即溶液酸性增强,有利于Na2S2O8产生SO4-。
⑵①FeSO4溶液被氧化产生Fe3+,可向溶液中加入KSCN检验,若溶液变红说明FeSO4溶液已被氧化,反之,没有被氧化。
②据图b中的数据分析知,当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为52.4%;则4-CP降解的平均反应速率的计算表达式为=
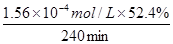 =
=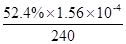
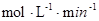 ;
;③当Fe2+浓度过高时,Fe2+会与SO4—发生氧化还原反应,消耗部分SO4—,反而导致4-CP的降解率下降。

练习册系列答案
相关题目

 2CO(正反应吸热),正反应的反应速率为v1;N2+3H2
2CO(正反应吸热),正反应的反应速率为v1;N2+3H2