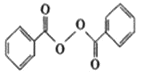
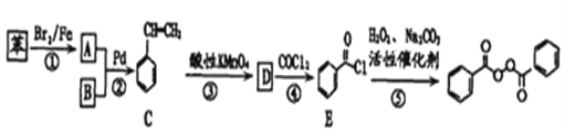
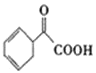
题目内容
【题目】在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:![]()
![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.保持容器容积不变,向其中加入![]() ,反应速率一定加快
,反应速率一定加快
B.保持容器容积不变,向其中加入![]() (
(![]() 不参加反应),反应速率一定加快
不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入![]() (
(![]() 不参加反应),反应速率一定加快
不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入![]() 和
和![]() ,反应速率一定加快
,反应速率一定加快
【答案】A
【解析】
A.增加反应物,其浓度增大,反应速率加快,A项正确;
B.加入氮气,因为容器容积不变,反应体系中各气体的浓度不变,故反应速率不变,B项错误;
C.保持压强不变,加入氮气,容器容积增大,反应体系中各气体的浓度减小,反应速率减小,C项错误;
D.保持压强不变,再次充入![]() 和
和![]() ,则容器容积增大为原来的2倍,反应体系中各气体的浓度不变,反应速率不变,D项错误。
,则容器容积增大为原来的2倍,反应体系中各气体的浓度不变,反应速率不变,D项错误。
答案选A。

【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH) =___________。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________