��Ŀ����
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
T | �������������ڲ����������4 |
X | �����������Ǵ�����������2�� |
Y | �����γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76g��L-1 |
Z | Ԫ����������븺�۵ľ���ֵ֮����6 |
��1��Ԫ��X��һ��ͬλ�ؿɲⶨ�������������ͬλ�صķ����� �������ڱ��е�λ���� ��
��2��Ԫ��Y����Ԫ���γ�һ������YH4����д����������Z�����γɻ�����ĵ���ʽ ��
��3��д��Ԫ��X��T�γɵĻ�����XT2�ĵ���ʽ ��
��4��Ԫ��Z��Ԫ��T��ȣ��ǽ����Խ�ǿ���� ����Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ���� ������ţ���
a��������Z�ĵ��ʺ�T�ĵ���״̬��ͬ
b��Z���⻯���T���⻯���ȶ�
c��һ��������Z��T�ĵ��ʶ���������������Һ��Ӧ
d���������ȣ�Z������������T���ɶ�����
e��Tԭ����Zԭ�ӵ��Ӳ�����ͬ��Zԭ�Ӱ뾶С��Tԭ��
��5��T�ĵͼ�������ͨ��Z���ʵ�ˮ��Һ�У�������Ӧ�Ļ�ѧ����ʽΪ ��
��6���ֱ��õ���ʽ��ʾZ��þԪ�ء�Y�뵪Ԫ���γɻ�����Ĺ���: ��
���𰸡���1��146C �ڶ�����IVA��
��2��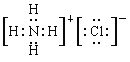
��3��![]()
��4��Cl b��d��e
��5��SO2+Cl2+2H2O��2HCl+H2SO4
��6��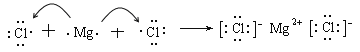
![]()
�����������������Tԭ���������������ڲ����������4����T�ǵ������ڵ�S��Xԭ�������������Ǵ�����������2�������X�ǵڶ����ڵ�C��Y�����γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76g��L-1������Է���������0.76��22.4��17����Y��N��ZԪ����������븺�۵ľ���ֵ֮����6����Z��Cl��
��1��̼Ԫ�ص�ԭ��������6��λ�ڵڶ�����IVA�壬�ɲⶨ�������ͬλ�صķ�����146C��
��2��Ԫ��N����Ԫ���γ�һ������NH4�������������������γɻ��������Ȼ�泥��������ӻ��������ʽΪ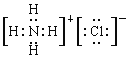 ��
��
��3��Ԫ��X��T�γɵĻ�������CS2�����й��ۼ��Ĺ��ۻ��������ʽΪ![]() ��
��
��4��ͬ�����������ҷǽ���������ǿ������Ԫ�صķǽ�����ǿ��SԪ�أ�a���ǽ�����ǿ���뵥��״̬û�й�ϵ��a����B���ǽ�����Խǿ���⻯��Խ�ȶ�����Z���⻯���T���⻯���ȶ�����˵���ǽ�����ǿ����b��ȷ��c��һ��������Z��T�ĵ��ʶ���������������Һ��Ӧ��ǽ�����ǿ��û�й�ϵ��c����d���������ȣ�Z������������T���ɶ���������˵����Ԫ�صķǽ�����ǿ�ڣ�d��ȷ��e��Tԭ����Zԭ�ӵ��Ӳ�����ͬ��Zԭ�Ӱ뾶С��Tԭ�ӣ�ͬ������������ԭ�Ӱ뾶��С���ǽ���������ȷ��e��ȷ����ѡbde��
��5�������ܰѶ���������������T�ĵͼ��������������ͨ��Z���ʵ�ˮ��Һ��ˮ�У�������Ӧ�Ļ�ѧ����ʽΪSO2+Cl2+2H2O��2HCl+H2SO4��
��6���Ȼ�þ�Ǻ������Ӽ������ӻ�������γɹ��̿ɱ�ʾΪ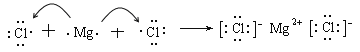 �������Ǻ��м��Լ��Ĺ��ۻ�������γɹ��̿ɱ�ʾΪ
�������Ǻ��м��Լ��Ĺ��ۻ�������γɹ��̿ɱ�ʾΪ![]() ��
��

 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�